
分析 (1)Ni原子核外电子数为28,根据能量最低原理书写核外电子排布式;
(2)由钛晶体的原子堆积方式可知,属于六方最密堆积;
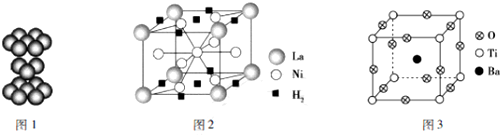
(3)根据均摊法计算晶胞中La、Ni原子数目,进而确定化学式;计算晶胞中氢气分子数目,结合晶胞中La与氢气分子数目之比计算1mol镧形成的该合金能储存氢气物质的量;
(4)①该晶体中的O元素与H形成的简单化合物为H2O,O原子形成2个O-H键,含有2对孤对电子;
②原子的得电子能力越强,其电负性的数值越大;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
③根据均摊法计算晶胞中O、Ti、Ba原子数目,进而确定化学式;
④结合晶胞含有原子数目计算晶胞质量,再根据V=$\frac{m}{ρ}$计算晶胞体积,晶胞边长=$\root{3}{{V}_{晶胞}}$.
解答 解:(1)Ni原子核外电子数为28,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)由钛晶体的原子堆积方式可知,属于六方最密堆积,原子配位数为12,即每个钛原子周围有12个紧邻的钛原子,
故答案为:12;
(3)算晶胞中La原子数目为8×$\frac{1}{8}$=1、Ni原子数目=1+8×$\frac{1}{2}$=5,故合金的化学式为LaNi5,晶胞中氢气分子数目为2×$\frac{1}{2}$+8×$\frac{1}{4}$=3,1mol镧形成的该合金能储存氢气物质的量为3mol,
故答案为:LaNi5;3;
(4)①该晶体中的O元素与H形成的简单化合物为H2O,O原子形成2个O-H键,含有2对孤对电子,氧原子采取sp3杂化,空间构型为V形,
故答案为:sp3;V形;
②元素原子的得电子能力越强,则电负性越大,所以F>O>N>C;
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能F>N>O>C,故答案为:F>N>O; N<O<F;
③晶胞中O氧原子数目为12×$\frac{1}{4}$=3、Ti原子数目为8×$\frac{1}{8}$=1、Ba原子数目1,故化学式为:BaTiO3,
故答案为:BaTiO3;
④晶胞质量=$\frac{137+48+16×3}{{N}_{A}}$g,晶体的密度为ρg/cm3,则晶胞边长=$\root{3}{\frac{\frac{233}{{N}_{A}}g}{ρg•c{m}^{-3}}}$=$\root{3}{\frac{233}{ρ{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{233}{ρ{N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、晶胞结构与计算等,注意理解金属晶体的堆积方式,对学生的空间想象有一定的要求,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、煤的干馏都是物理变化 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 可用乙醇萃取溴水中的溴 | |
| D. | 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| C. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
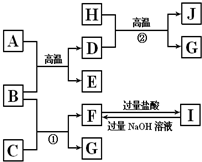 图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.
图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-=Al(OH)3↓ | |
| B. | 纯碱溶液使酚酞变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | 乙酸清除水垢后的化学反应原理:2H++CO32-=CO2↑+H2O | |
| D. | FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++Fe=3Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com