
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:分析 (1)铁是26号元素,位于周期表中第四周期第ⅤⅢ族;
(2)K3[Fe(CN)6]遇Fe2+,出现特殊的蓝色沉淀,可用于检验Fe2+,根据C原子价层电子对个数确定杂化方式;一般来说非金属性越强,第一电离能越大,但是因为p轨道半充满体系具有很强的稳定性,会有特例,如N的p轨道本来就是半充满的,O的p轨道失去一个电子才是半充满的,所以O比N容易失去电子;
(3)分子晶体的熔沸点较低;配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;根据生成物判断形成的化学键;
(4)①铜为29号元素,据此写出基态铜原子的核外电子排布式;
②根据晶胞结构图可知,铜为面心立方堆积,据此判断每个铜原子周围距离最近的铜原子数目;
(5)根据价电子排布式判断出X原子为Cl原子;
①利用均摊法计算得出;
②根据电负性差值判断化合物类型;
③计算出一个晶胞中微粒数,利用化合物的摩尔质量和密度计算出晶胞边长,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$.
解答 解:(1)铁是26号元素,位于周期表中第四周期第ⅤⅢ族,
故答案为:第四周期第ⅤⅢ族;
(2)K3[Fe(CN)6]遇Fe2+,出现特殊的蓝色沉淀,可用于检验Fe2+,CN-中C原子价层电子对个数=1+$\frac{1}{2}$(4+1-1×3)=2,所以采取sp杂化;一般来说非金属性越强,第一电离能大,但是因为p轨道半充满体系具有很强的稳定性.N的p轨道本来就是半充满的.O的p轨道失去一个电子才是半充满的.所以C、N、O三元素的第一电离能由大到小的顺序为N>O>C,
故答案为:Fe2+;sp杂化;N>O>C;
(3)分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,所以形成的化学键为金属键,
故答案为:分子晶体;5;金属键;
(4)①铜为29号元素,基态铜原子的核外电子排布式为[Ar]3d104s1 或1s22s22p63s23p63d104s1,
故答案为:[Ar]3d104s1 或1s22s22p63s23p63d104s1;
②根据晶胞结构图可知,铜为面心立方堆积,所以每个铜原子周围距离最近的铜原子位于经过该原子的立方体的面的面心上,共有12个,
故答案为:12;
(5)根据价电子排布式判断出X原子为Cl原子;
①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上,晶胞中含有Cl原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化学式为CuCl,
故答案为:CuCl;
②电负性差值大于1.7原子间易形成离子键,小于1.7原子间形成共价键,铜与X的电负性分别为1.9和3.0,差值为1.1小于1.7,形成共价键,
故答案为:共价;
③一个晶胞的摩尔质量为4×99.5g/mol,晶胞摩尔体积为$\frac{4×99.5}{ρ}$cm3,晶胞的边长为$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$,而体对角线为晶胞边长的$\sqrt{3}$倍,所以铜原子和M原子之间的最短距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010.
点评 本题考查较为全面,涉及到电子排布式、第一电离能、杂化类型的判断、配合物以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:填空题
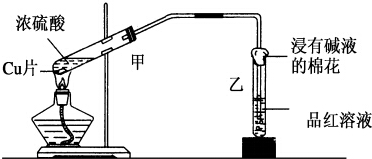 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 食盐水中滴加硝酸银溶液:Ag++Cl-═AgCl↓ | |
| D. | 石灰石与盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| B. | 向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | Ca(HCO3)2溶液中加入少量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.
如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物的总能量小于反应物的总能量 | |
| B. | 该反应的燃烧热为905KJ | |
| C. | 该反应为放热反应 | |
| D. | 该反应中每4molNH3(g)被氧化,放出905 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com