
| X | Y | ||
| Z | W | M |
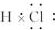 ,故答案为:
,故答案为: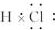 ;
;

科目:高中化学 来源: 题型:
| A、1.8g重水(D2O)中含NA个中子 |
| B、NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
| C、标准状况下,含有NA个分子的氧气和氮气的混和气体的体积约为22.4L |
| D、制取漂白粉的反应中,每消耗7.1g Cl2,则转移0.2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
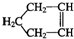 可简写为
可简写为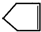 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: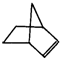
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
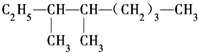 的系统命名法名称是
的系统命名法名称是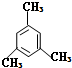 的名称是
的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
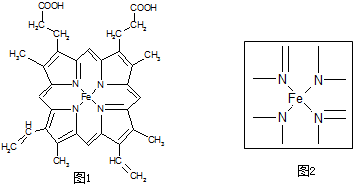
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com