
【题目】A、B、C、D、E、F为前四周期元素,且原子序数依次增大。A是元素周期表中半径最小的元素,B的基态原子2p轨道上未成对电子数是C的3倍;D的基态原子含13种运动状态不同的电子;E与A位于同一主族;F2+的3d轨道中有9个电子。(答题时用字母对应的元素符号表示)
⑴元素A、B、C的电负性由大到小的顺序为______。
⑵F的基态原子价层电子排布式为______。
⑶BC3的空间构型为______,与BC3互为等电子体的一种阴离子的化学式为______。
⑷一种化合物X的晶体结构如图,X的化学式为______。 (图中○:E+,●:DC![]() )
)
⑸化合物AC与EC中熔点更高的是_________,原因是________。
【答案】F、N、H 3d104s1 三角锥形 SO32- K3AlF6 KF KF是离子晶体,HF是分子晶体,离子键的作用强于分子间作用力
【解析】
A、B、C、D、E、F为前四周期元素,且原子序数依次增大。A是元素周期表中半径最小的元素,则A为H元素;B的基态原子2p轨道上未成对电子数是C的3倍,p轨道最多为3个未成对的电子,则B的基态原子核外电子排布式为1s22s22p3,C的基态原子核外电子排布式为1s22s22p5,故B为N元素,C为F元素;D的基态原子含13种运动状态不同的电子,则D为Al元素;E与A位于同一主族,则E为K元素;F2+的3d轨道中有9个电子,则F的价层电子排布式为3d104s1,故F为Cu元素。
(1)元素A、B、C分别为H、N、F,非金属性越强,电负性越强,非金属性:F>N>H,电负性由大到小的顺序为F、N、H,
答案为:F、N、H;
⑵F为Cu元素,基态原子价层电子排布式为3d104s1,
答案为:3d104s1;
⑶BC3为NF3,根据价层电子互斥理论,价层电子对数为3+![]() (5-3)=4,则空间构型为三角锥型;NF3由四个原子组成,最外层电子数之和为26,与NF3互为等电子体的一种阴离子的化学式为SO32-,
(5-3)=4,则空间构型为三角锥型;NF3由四个原子组成,最外层电子数之和为26,与NF3互为等电子体的一种阴离子的化学式为SO32-,
答案为:三角锥形;SO32-;
⑷如图所示,E+的数目为9+12×![]() =12个,DC
=12个,DC![]() 的数目为8×
的数目为8×![]() +6×
+6×![]() =4,可得:E+与DC
=4,可得:E+与DC![]() 的数目之比为3:1,根据化合物中化合价之和为0,则(+1)×3+(-1)×n=0,n=3,即DC
的数目之比为3:1,根据化合物中化合价之和为0,则(+1)×3+(-1)×n=0,n=3,即DC![]() 为AlF
为AlF![]() ,F在化合物中只有-1价,Al为+3价,则3+(-1)×m=-3,故m=6,因此X的化学式为K3AlF6,
,F在化合物中只有-1价,Al为+3价,则3+(-1)×m=-3,故m=6,因此X的化学式为K3AlF6,
答案为:K3AlF6;
⑸化合物AC为HF,EC为KF,HF为分子晶体,KF为离子晶体,离子键的作用强于分子间作用力,故熔点更高的是KF,
答案为:KF;HF为分子晶体,KF为离子晶体,离子键的作用强于分子间作用力。


科目:高中化学 来源: 题型:
【题目】石油裂解可以得到乙烯、丙烯等小分子烃,它们是常见的有机化工原料。下图是以丙烯为原料合成有机物I的流程。
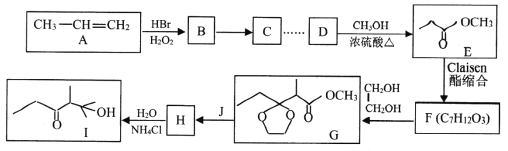
已知:
i.Claisen酯缩合: ![]()
ii. 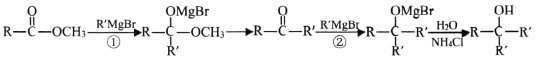 (②比①反应快)
(②比①反应快)
iii.![]() ,(R、R'代表烃基)
,(R、R'代表烃基)
回答下列问题:
(1)C的名称为_____________。Ⅰ中所含官能团的名称为______________________。
(2)B→C的反应类型是_______________。F的结构简式为_______________________。
(3)D→E的化学方程式为___________________________。
(4)由F到H过程中增加一步先生成G再生成H的目的是__________________________。
(5)化合物K与E互为同分异构体,已知1molK能与2mol金属钠反应,则K可能的链状稳定结构有_______种(两个一OH连在同一个碳上不稳定:一OH连在不饱和的双键碳、叁键碳不稳定),其中核磁共振氢谱有三组峰的结构简式为_______________。(任写一种)
(6)完成下列以苯乙烯为原料,制备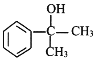 的合成路线(其他试剂任选) _____________。
的合成路线(其他试剂任选) _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
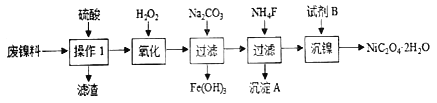
下列说法不正确的是
A. 操作1的名称为过滤,为了加快过滤速度要使用玻璃棒搅拌
B. 加入H2O2的目的是将 Fe2+氧化为 Fe3+
C. 加入NH4F的目的是除去钙离子、镁离子
D. 试剂 B的名称为草酸或可溶性的草酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃,向体积为VL的密闭容器中充入NO,容器内各组分的物质的量随时间变化曲线如图所示。下列说法正确的是

A.X是N2O
B.1 min~3 min时,v(NO2)=1/6Vmol·(L·min)-1
C.40℃时该反应的平衡常数为1
D.NO2和X的浓度相等可以作为判断反应到达平衡的标志
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抑制结核杆菌的药物 PAS-Na(对氨基水杨酸钠)的合成:
已知:①![]() (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)
②![]()
③R-Cl![]() R-OH
R-OH
下面是 PAS-Na 的一种合成路线(部分反应的条件未注明):

按要求回答问题:
(1)下列说法正确的是_______________;
A.化合物A只能发生氧化反应,不能发生还原反应
B.反应A →B为取代反应
C.反应II和反应III可以调换顺序
D.对氨基水杨酸 既能与酸反应,也能与碱反应
既能与酸反应,也能与碱反应
(2)写出反应Ⅰ的化学方程式_________________________;
(3)写出下列物质的结构简式:C:____________________;
(4)一种有机物 E,它是化合物 A 的同系物,每个分子中比 A 多二个碳原子;1H-NMR 谱显示 E 分子中含有苯环,且苯环上有两种不同化学环境的氢原子,请写出符合以上条件的 E 的所有同分异构体的结构简式: ____________________________。
(5)写出以 A 为原料制备 的合成路线(用流程图表示,无机试剂任选)_____________________。
的合成路线(用流程图表示,无机试剂任选)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学化学常用的试剂。主要用于防腐、化工、制药等。实验室模拟工业上用软锰矿制备高锰酸钾的流程如下:
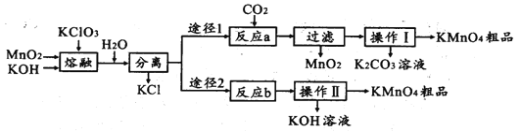
(1)实验室熔融二氧化锰、氧氧化钾、氯酸钾时应选择____________________________
a.普通玻璃坩埚 b.石英坩埚 c.陶瓷坩埚 d.铁坩埚
(2)第一步熔融时生成K2MnO4的化学方程式:______________________________________
(3)操作Ⅰ中根据KMnO4和K2CO3两物质在____________ (填性质)上的差异,采用浓缩结晶、趁热过滤得到KMnO4。趁热过滤的原因是______________________________________
(4)反应b是电解法制备KMnO4,其装置如图所示,a作____________极(填“阳”或“阴”),中间的离子交换膜是_____ (填“阳”或“阴”)离子交换膜。阳极的电极反应式为____________
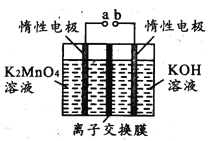
(5)取反应b后的电解液,加硫酸溶解后,用0.1000mol ·L-1FeSO4标准溶液滴定至终点时,消耗250.0mL标准溶液,则电解后溶液中的KMnO4的质量是_________g。
(6)两种途径的制备方法,途径1与途径2理论产率之比为_________
(7)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填标号)。
a.双氧水 b.84消液(NaClO溶液) c.75%酒精 d.苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热还原法制备MgO材料的原理为MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
A. 活化能:E正>E逆
B. 其他条件不变,加入催化剂,△H减小
C. 其他条件不变,降低温度,化学平衡常数增大
D. 其他条件不变,向容器中通入Ar(g),平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(注意溴原子的连接位置,下同),1 mol某芳香烃A充分燃烧后可以得到9 mol CO2和5 mol H2O,该烃苯环上的一氯代物有2种。该烃A在不同条件下能发生如下所示的一系列变化。

请回答下列问题
(1)写出A的结构简式:__________,A中官能团的名称是________。
(2)上述反应中,②是________反应,⑦是________反应。(填反应类型)
(3)写出D、E物质的结构简式:D_______,E_______。
(4)写出A→C反应的化学方程式:____________________。
(5)写出F→H反应的化学方程式:________________。
(6)写出F催化氧化反应的化学方程式:___________。
(7)下列关于F的说法不正确的是______(填序号)。
a. 能发生消去反应 b. 能与金属钠反应
c. 1mol F最多能和4mol氢气反应 d. 分子式C9H11O
e. 能使酸性高锰酸钾褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种食品添加剂,具有防腐和抗氧化作用。某同学对亚硝酸钠进行了相关探究。
(一)查阅资料
①亚硝酸钠(NaNO2)为无色、无味的晶体。
②HNO2是一种弱酸,酸性比醋酸略强,性质不稳定,易分解生成NO和NO2;能被常见强氧化剂氧化;但在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。
③AgNO2是一种微溶于水、易溶于酸的浅黄色固体。
(二)问题讨论
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是__________________________________________。
若发生中毒时,你认为下列物质有助于解毒的是______(填字母)。
a.鸡蛋清 b.胃舒平 [主要成分是Al(OH)3] c.小苏打 d.维生素C
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl两种固体,你需用的试剂是_____________________________。
(三)实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:①称取样品a g,加水溶解,配制成100 mL溶液。②取25.00 mL溶液于锥形瓶中,用0.0200mol·L-1 KMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液 V mL。
(3)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________________。
(4)在进行滴定操作时,KMnO4溶液盛装在________(填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,____________________________________________________时达到滴定终点。
(5)滴定过程中发生反应的离子方程式是_________________________________;测得该样品中NaNO2的质量分数为________。
(6)若滴定过程中刚出现颜色变化就停止滴定,则测定结果________。(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com