
 酸碱中和滴定在生产实际中有着广泛的应用.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL的一元酸HR溶液时,溶液的pH变化情况如图所示,其中a点表示两种物质恰好完全反应.请回答下列问题:
酸碱中和滴定在生产实际中有着广泛的应用.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL的一元酸HR溶液时,溶液的pH变化情况如图所示,其中a点表示两种物质恰好完全反应.请回答下列问题:| n(NaOH) |
| V(HR) |
| 0.250mol/L×0.02L |
| 0.025L |
| c(H+)?c(R-) |
| c(HR) |
| 0.001×0.001 |
| 0.2-0.001 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、铝与氢氧化钠溶液反应:2Al+2OH-=2AlO2-+3H2O |
| B、将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O |
| C、向氢氧化钠溶液中通入少量CO2:OH-+CO2=HCO3- |
| D、用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
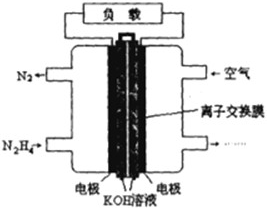 肼(N2H4)是火箭发射常用的燃料.
肼(N2H4)是火箭发射常用的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 时间(min ) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强碱溶液中:Na+、Mg2+、SO42-、AlO2- |
| B、某无色溶液中:NH4+、Fe3+、MnO4-、NO3- |
| C、含有0.1mol/L Fe3+溶液中:K+、Mg2+、Cl-、SCN- |
| D、与铝反应生成H2的溶液中:Na+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将NH3通过热的CuO,有红色固体生成 |
| B、将SO2通入过量BaCl2溶液可生成BaSO3沉淀 |
| C、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| D、Li在氧气中燃烧主要生成Li2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com