
已知下述三个实验中的物质均能发生化学反应。
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
下列判断正确的是( )
A.实验①和③中的铁钉只作还原剂
B.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
C.实验②中Fe2+既显氧化性又显还原性
D.实验③中反应的离子方程式为Fe+Fe3+===2Fe2+
科目:高中化学 来源: 题型:
将40 g NaOH溶于水中,配制成1 L溶液,则该溶液的物质的量浓度为( )。
A.0.1 mol/L B.0.5 mol/L C.4 mol/L D.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
A为药用有机物,从A出发可发生下图所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
|
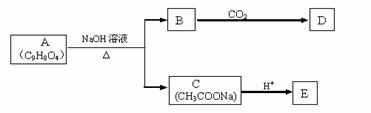
(1)A中所含官能团的名称为______________;A转化为B、C时,涉及到的反应类型有_____________________________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。则Q、R的结构简式为Q__________________、R______________________。
(3)写出B与过量CO2反应的化学方程式__________________。
(4)A在加热条件下与NaOH溶液反应的化学方程式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
离子方程式H++OH-=H2O可表示的化学方程式是
A.盐酸与氢氧化铜的反应 B.硫酸与氢氧化钡的反应
C.硫酸与氢氧化钠的反应 D.盐酸与氨水的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
“低碳生活”是指生活作息时所耗用能量要减少,从而降低碳特别是二氧化碳的排放。下列行为不利于低碳生活的是:
A.处理废弃塑料制品较为合理的方法是使用化学方法加工成防水涂料或汽油
B.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
C.实现资源的“3R”,即减少消耗(Reduce)、增加重复使用(Reuse)、重复再生(Recycle)
D.逐步推广天然气,代替石油和煤的使用
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液,其中可能存在Na+、Ba2+、AlO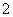 、S2-、SO
、S2-、SO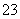 、SO
、SO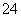 。取该溶液进行有关实验,实验结果如左图所示。
。取该溶液进行有关实验,实验结果如左图所示。
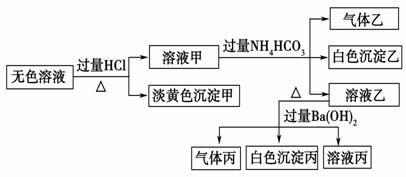
请回答下列问题:
(1)沉淀甲的化学式为________。
(2)由溶液甲生成沉淀乙的离子方程式为______________。
(3)沉淀丙中一定含有___________(填化学式,下同),可能含有__________。
(4)综合上述信息,该溶液中肯定存在的离子有_________。
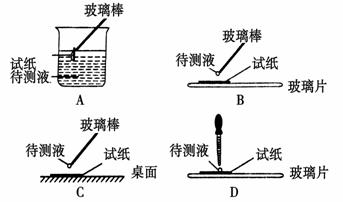 (5)该溶液显性 (填酸性、碱性或中性),若要检验其酸碱性,下图操作正确的是 。
(5)该溶液显性 (填酸性、碱性或中性),若要检验其酸碱性,下图操作正确的是 。
请用离子方程式表示显碱性的原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表达不正确的是
A.NaHS在水中的电离方程式为:NaHS=Na++HS-和HS-=H++S2-
B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl)
C.Na2SO3溶液中:c(H+)+c(HSO3-)+ 2c(H2SO3)=c(OH-)
D.同浓度的下列溶液中,c (CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。

(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式__________,它位于周期表____________区。
(2) 富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为________;1 mol C60分子中σ键的数目为____________个。
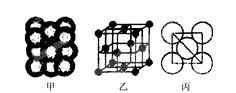
(3)Cu单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中Cu原子的配位数为____________,一个晶胞中Cu原子的数目为________。
(4)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是________.________。
(5)下列说法正确的是________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔.沸点越高
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液, 搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是
A.Fe3+ B.Mg2+ C.Fe2+ D.Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com