

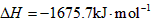

 Na2S(s) + 4H2O(g) 。 ①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
Na2S(s) + 4H2O(g) 。 ①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| ||
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| ||
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |
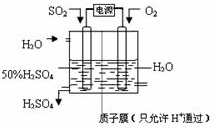
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省荆州市毕业班质量检查(一)化学试卷(解析版) 题型:填空题
(1)已知:①Fe(s)+1/2O2(g)=FeO(s) △H1=-272.0KJ·mol-1
②2Al(s)+3/2(g)=Al2O3(s) △H2=-1675.7KJ·mol-1
Al和FeO发生铝热反应的热化学方程式是__ __。
某同学认为,铝热反应可用于工业炼铁,你的判断是_ (填“能”或“不能”),你的理由

(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A.B,如图所示。①据图判断该反应是 (填“吸”或“放” )热反应,当反应达到平衡后,其他条件不变,,升高温度,反应物的转化率将 (填“增大”、 “减小”或“不变”)。
②其中B历程表明此反应采用的条件为
(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省潮州市潮安县松昌中学高二(上)期中化学试卷(解析版) 题型:解答题
 O2(g)=FeO(s)△H=-272.0kJ?mol-1
O2(g)=FeO(s)△H=-272.0kJ?mol-1 O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1
O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com