
| A. | 常温常压下,11.2L SO3含有的分子数少于0.5NA | |
| B. | 1mol•L-1的Ca(ClO)2溶液中含ClO-数目为2NA | |
| C. | 标准状况下,2.24L四氯化碳中“C-Cl”键为0.4NA | |
| D. | 1molNa被完全氧化生成Na2O2,失去2NA个电子 |
分析 A.常温下的气体摩尔体积大于22.4L/mol,11.2L三氧化硫的物质的量小于0.5mol;
B.次氯酸钙溶液中,次氯酸根离子部分水解,导致次氯酸根离子的数目减少,且题中缺少溶液体积;
C.标准状况下四氯化碳的状态不是气体;
D.钠为+1价金属,1mol钠完全反应最多失去1mol电子.
解答 解:A.常温下的温度大于标况下,则常温下的气体摩尔体积大于22.4L/mol,11.2L三氧化硫的物质的量小于0.5mol,含有的分子数少于0.5NA,故A正确;
B.没有告诉次氯酸钙溶液的体积,无法计算溶质的物质的量,且次氯酸根离子部分水解,无法计算溶液中次氯酸根离子的数目,故B错误;
C.标况下四氯化碳为液体,不能使用标况下的气体摩尔体积计算其物质的量,故C错误;
D.1mol钠完全反应生成0.5mol过氧化钠,反应中失去1mol电子,失去NA个电子,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,试题涉及的知识点较多、考查较全面,注意明确标况下气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系.


科目:高中化学 来源: 题型:选择题
| A. | H2O2溶液中加入MnO2可制得O2,产生2.24L(标况)O2,转移0.4NA个电子 | |
| B. | SO2和CO2都属于酸性氧化物,Na2O和A12O3都属于碱性氧化物 | |
| C. | 在氯化铵水溶液中,既存在水解平衡,又存在电离平衡 | |
| D. | O2在放电的条件下生成O3属于化学变化,电解质溶液导电属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有Cl- | B. | 一定有SO42- | C. | 一定没有Al3+ | D. | 一定没有SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
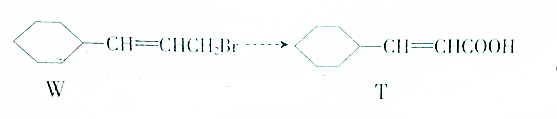
| A. | ①③②④ | B. | ③①④② | C. | ②①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为( )
某离子晶体中晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体化学式可能为( )| A. | CaF2 | B. | CaO2 | C. | CaC2 | D. | Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硼的原子半径大于铍的原子半径 | |
| B. | 氯化铍分子中铍原子的最外层电子数是8 | |
| C. | 氢氧化铍的碱性比氢氧化钙弱 | |
| D. | 单质铍跟冷水反应产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
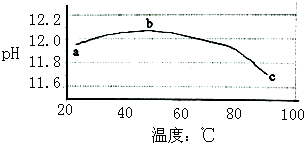 某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )
某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )| A. | 碳酸钠水解是吸热反应 | B. | ab段说明水解平衡向右移动 | ||
| C. | bc段说明水解平衡向左移动 | D. | 水的电离平衡也对pH产生影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与水完全反应时转移电子数为NA | |
| B. | 18g重水(D2O)所含的电子数为10NA | |
| C. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| D. | 标准状况时,1LpH=13的NaOH溶液中含有的OH-离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com