
 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:分析 根据E为无色无味的液体,F为淡黄色粉末,则F为过氧化钠,E为水,G为氧气,H为氢氧化钠
(1)根据E为无色无味的液体,F为淡黄色粉末,则F为过氧化钠,E为水,G为氧气,H为氢氧化钠,根据生成的气体与转移电子之间的关系式计算每生成2.24L气体G(标准状况)时转移电子的物质的量,根据元素的化合价判断反应,写出相应的离子反应方程式;
(2)含有氯元素的歧化反应是氯气和氢氧化钠的反应;
(3)C、D是两种均能使澄清的石灰水变浑浊的无色气体推断C、D是二氧化碳、二氧化硫,根据碳和浓硫酸的反应来回答;
(4)中性干燥剂是氯化钙,氯化铵和氢氧化钙发生反应可以获得,根据热化学方程式的含义和书写知识来回答.
解答 解:E为常温下无色无味的液体且在生成物中,所以是水.F为淡黄色粉末,是过氧化钠或硫,但能和水反应,所以是过氧化钠.过氧化钠和水反应的生成物是氧气和氢氧化钠,G为常见的无色气体,所以G是氧气,H是氢氧化钠.
(1)F为过氧化钠,其化学式为,Na2O2;
设该反应转移电子的物质的量xmol
2Na2O2+2H2O=4NaOH+O2↑ 转移电子数
22.4L 2mol
2.24L x
x=0.2mol,
故答案为:Na2O2;0.2;
(2)若A为Cl2,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则A是氯气,与碱反应,生成盐酸盐、次氯酸盐和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)若C、D是两种均能使澄清的石灰水变浑浊的无色气体,即C、D是二氧化碳和二氧化硫,E为水,A为非金属单质,所以C、D、E是浓硫酸和碳反应的产物,则A为C,B为浓H2SO4,
故答案为:C;浓H2SO4;
(4)若A与B均为固体化合物,C是常见的一种中性干燥剂即氯化钙,所以A和B的反应可以是氯化铵和氢氧化钙生成氨气、氯化钙和水的反应,即2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
点评 本题考查的是物质或离子的推断、离子方程式的书写、物质的量的有关计算,属于综合知识的考查,难度较大


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
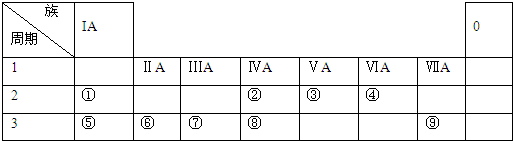
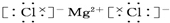 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S | |
| B. | 用右图装置电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+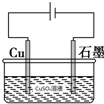 | |
| C. | NaHCO3溶液使酚酞试液变红:HCO3-+H2O?H3O++CO32- | |
| D. | 用AlCl3溶液使石蕊试液变红:Al3++3H2O?Al(OH)3+3 H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 | |
| D. | 氨气在水中溶解度很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Li>Na | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数相同 | D. | 核外电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测的现象 |
| A | 淀粉KI溶液 | 浓硝酸 | ①中溶液变蓝 |
| B | 浓盐酸 | 浓氨水 | 大烧杯上部出现白烟 |
| C | 酚酞试液 | 浓盐酸 | ①中溶液变红 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
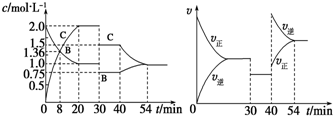
| A. | 8 min时表示正反应速率等于逆反应速率 | |
| B. | 前20 min A的反应速率为0.05 mol•L-1•min-1 | |
| C. | 反应方程式中的x=1,30 min时表示增大压强 | |
| D. | 40 min时改变的条件是升高温度,且正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
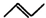 ,有一种有机物X的键线式如图所示.
,有一种有机物X的键线式如图所示.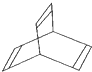
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com