
【题目】NA表示阿伏加罗常数的值,下列说法正确的是( )
A. 常温常压下,2.2gCO2中含有的分子数为0.05NA
B. 0.5molNa2CO3固体中含有的Na+数为0.5NA
C. 32 g O2所含的原子数目为NA
D. 标准状况下,2.24LCCl4含有的碳原子数为0.1NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.0×10-11。常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/L'HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
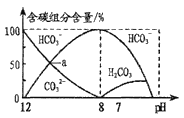
下列说法正确的是
A. 在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
B. a点时:c(Na+)+c(H+)=c(OH-)+3c(CO32-)
C. 当pH=7时,溶液中c(Na+)=c(HCO3-)+2c(CO32-)
D. 当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
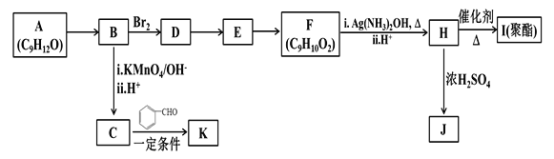
已知以下信息:
①A是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
②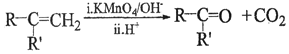
③RCOCH3+RCHO![]() RCOCH=CHR
RCOCH=CHR
回答下列问题:
(1)A生成B的反应类型为________,由D生成E的反应条件为________。
(2)H 的官能团名称为________。
(3)I的结构简式为_______。
(4)由E生成F的反应方程式为________ 。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为_______。
①能发生水解反应和银镜反应;②属于芳香族化合物且分子中只有一个甲基;
③具有5个核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水溶液中逐滴加入0.1000mol/L的HCl溶液,测得混合溶液的温度变化如图。下列相关说法正确的是
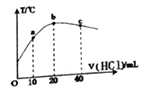
A. a、b、c点的水的电离程度依次增大
B. 判断溶液的pH:b点pH=7,c点pH<7
C. 己知25℃时0.2mol/L氨水电离度为1.33%,此时氨水的pH 约为12
D. 若a点溶液呈碱性,则a点有c(NH4+)>c(Cl-)>c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____________。
(2)在一密闭容器中投入一定量的氨气,发生反应2NH3![]() N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
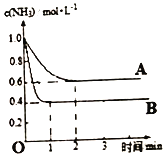
请回答:
①曲线A中,反应在前2min内氢气的平均反应速率为________。此条件下的平衡常数K=____。
②在其它条件相同时,若改变某一条件,使该反应发生如图曲线B的反应情况,则此条件可能是改变_________(填“浓度”、“压强”、“温度”或“催化剂”)。简述判断理由_________。
(3)一定温度下,在恒压密闭容器中N2O5可发生下列反应:
①2N2O5(g)![]() 4NO2(g)+O2(g) ②2NO2(g)
4NO2(g)+O2(g) ②2NO2(g)![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6mol/L,c(O2)=1.2mol/L,则反应②中NO2的转化率为______,N2O5(g)的起始浓度应至少大于______mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β-羰基酯,同时失去一分子醇,该反应称克菜森(R·L·Claisen)酯缩合反应,其反应机理如下:
2RCH2COOC2H5 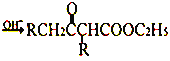 +C2H5OH 利用Claisen反应制备化合物I的一种合成路线如下:
+C2H5OH 利用Claisen反应制备化合物I的一种合成路线如下:
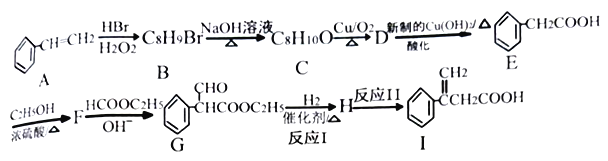
回答下列问题:
(1)E的名称为_______,F的结构简式为_______。
(2)I中官能团的名称是_______,反应I的反应类型是_______。
(3)F→G反应的化学方程式为_______。
(4)满足下列条件E的同分异构体有_____种。
①含有苯环,能发生水解反应 ②分子结构中含有一个甲基
其中分子结构中只有一个侧链的有机物结构简式为______、_______。
(5)乙酰乙酸乙酯(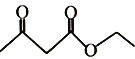 )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线________(无机试剂任选)。
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd (钯,银白色)。如图是某工厂回收其中部分金属的流程图.(假设流程图中各反应均恰好完全反应.己知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)步骤②中产生的气体是________(写化学式)。
(2)滤渣2中含有的金属是________
(3)步骤⑤反应的化学方程式________。
(4)步骤⑥回收的纯净物B是________ (写化学式).
(5) 金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。该电池工作一段时间后,可由太阳能电池充电。下列说法不正确的是
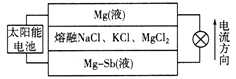
A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为:Mg2++2e—=Mg
C. 该电池充电时,Mg—Sb(液)层发生还原反应
D. 该电池充电时,C1—向中层和下层分界面处移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com