
【题目】秋冬季是雾霾高发季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NOX可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_______________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
N2(g)+2CO2(g)△H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
c(CO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(CO)=V(CO2)
②此条件下达到平衡时,计算该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有_____________________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2和氮的氧化物气体(NOx),请写出氢氧化钠溶液吸收NO和NO2(两者体积比1:1)的离子方程式 ___________________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。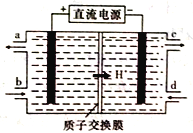
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
【答案】CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol AC 2.56×105 降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等(写出两种即可) NO+NO2 +2OH- =2NO2- +H2O a 2NO2-+8H++6e-=N2↑+4H2O
N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol AC 2.56×105 降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等(写出两种即可) NO+NO2 +2OH- =2NO2- +H2O a 2NO2-+8H++6e-=N2↑+4H2O
【解析】
(1)①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
利用盖斯定律将(①+②)![]() 2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),以此计算反应热;
2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),以此计算反应热;
(2)①根据平衡状态时,各物质浓度保持不变,正反应速率等于逆反应速率以及相关量不变来判断;
②利用三段式法计算平衡浓度,根据平衡常数表达式计算;
③为了提高尾气处理的效果,可从增大转化率和加快反应速率角度分析;
(3)从氧化还原反应的角度判断反应产物,进而写出相关反应的离子方程式;
(4)①Ce4+是氧化产物,在阳极生成,从电解槽的a口流出。
②阴极发生还原反应,在阴极NO2-转化为N2,以此写出阴极的电极反应式。
(1)将已知的两个热化学方程式相加再除以2可得甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=[(-574kJ/mol)+(-1160kJ/mol
)]=一867kJ/mol,
因此,本题正确答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=一867kJ/mol;
(2)①A.c(NO)随着反应进行而改变,当c(NO)不再改变时,说明反应达到平衡状态,故A可判断反应达到平衡状态;
B.c(NO)/c(CO)与平衡状态之间没有一定关系,故B不能判断反应达到平衡状态;C.c(NO/c(CO2)随着反应进行而改变,当c(NO/c(CO2)不再改变时,说明反应达到平衡状态,故C可判断反应达到平衡状态;
D.V(NO)和V(CO)都是正反应速率,不能说明正反应速率等于逆反应速率,故D不能判断反应达到平衡状态。
故选AC。
② 2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(×10-3mol/L)9.00 9.00 0 0
转化(×10-3mol/L) 8.00 8.00 4.00 8.00
平衡(×10-3mol/L) 1.00 1.00 4.00 8.00
由此可知,此条件下达到平衡时,c(NO)=1.00×10-3mol/L,c(CO)=1.00×10-3mol/L,c(CO2)=8.00×10-3mol/L,c(N2)=4.00×10-3mol/L,
该反应的平衡常数K=![]() =
=![]() =2.56×105,
=2.56×105,
③为了提高尾气处理的效果,可采取的措施有降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等。
因此,本题正确答案为:AC ;2.56×105;降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等(写出两种即可);
(3)氢氧化钠溶液吸收NO和NO2(两者体积比1:1)则生成NO2-,离子方程式为NO+NO2 +2OH- =2NO2- +H2O,
因此,本题正确答案为:NO+NO2 +2OH- =2NO2- +H2O;
(4)①Ce4+是氧化产物,在阳极生成,从电解槽的a口流出;
②阴极发生还原反应,在阴极NO2-转化为N2,则阴极的电极反应式为:2NO2- +8H++6e-=N2↑+4H2O,
因此,本题正确答案为:a ;2NO2-


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为________________(用元素符号表示);
(2)N3-的立体构型是___________形:与N3-互为等电子体的一种分子是___________(填分子式)。
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为___________;SO42-中的硫原子杂化方式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
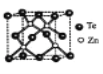
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成____体图形;与Te原子距离最近的Te原子有___个;若Zn与距离最近的Te原子间距为apm,则晶体密度为____g/cm3。
(已知相对原子质量:Zn-65、Te-128)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOX可以消除氮氧化物的污染,例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH2=﹣1 160 kJmol﹣1。
已知NO、NO2混合气体的密度是相同条件下氢气密度的17倍,16 g甲烷和该混合气完全反应生成N2、CO2、H2O(g)放出1 042.8 kJ的热量,则ΔH1是( )
A. ﹣867 kJmol﹣1 B. ﹣574 kJmol﹣1 C. ﹣691.2 kJmol﹣1 D. ﹣925.6 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氯元素全部被氧化的是( )
A. 2P+3Cl2![]() 2PCl3
2PCl3
B. 2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
C. NaOH+HClNaCl+H2O
D. 2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的_________。
A.用石斧解剖 B.早期的农业耕作
B.早期的农业耕作
C.简单机械织布![]() D.祥云火炬燃烧
D.祥云火炬燃烧![]()
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
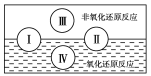
试写出一个有水生成的属于类型Ⅲ的化学方程式_________;
有水参加的反应:C+H2O(g)![]() CO+H2,符合图中反应类型______(填标号)。
CO+H2,符合图中反应类型______(填标号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应方程式书写不正确的是
A. 用氢氟酸雕刻玻璃:SiO2+4HF=SiF4↑+2H2O
B. 工业上用电解法制镁:MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
C. 将铝片打磨后放入氢氧化钠溶液中:2Al+2OH﹣=2AlO2-+H2↑
D. 氢氧化亚铁暴露于空气中:4Fe(OH)2 +O2 +2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂和乙酸乙酯的比较正确的是( )
A.油脂和乙酸乙酯都是纯净物,在室温下都是液体
B.油脂和乙酸乙酯在碱性条件下的水解反应都是皂化反应
C.乙酸乙酯和油脂都有果香味,乙酸乙酯是一种特殊的油脂
D.油脂和乙酸乙酯都难溶于水,而易溶于有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用图所示的装置及药品进行酸性强弱比较的实验,下列说法正确的是

A. ①和②中发生的反应均为氧化还原反应
B. 向Na2SiO3饱和溶液中滴酚酞溶液无明显现象
C. 一段时间后②中有胶冻状物质生成
D. 该实验能证明酸性强弱的顺序是:碳酸>硫酸>硅酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com