
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
分析 铁的还原性强于铜,所以Fe3+先和铁发生反应:Fe+2Fe3+=3Fe2+,反应后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=2Fe2++Cu2+,所以剩余的固体是铜或铁和铜,
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol•L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu,由此分析解答.
解答 解:铁的还原性强于铜,所以Fe3+先和铁发生反应:Fe+2Fe3+=3Fe2+,反应后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=2Fe2++Cu2+,所以剩余的固体是铜或铁和铜,
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol•L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu,
(1)实验②中剩余的0.64g全部为Cu,则溶解的Fe、Cu的总质量为:1.80g-0.64g=1.16g,
设溶解的Fe、Cu的物质的量分别为x、y,则$\left\{\begin{array}{l}{56x+64y=1.16}\\{2x+2y=0.04}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=0.015mol}\\{y=0.005mol}\end{array}\right.$,所以铜的物质的量为:0.005+$\frac{0.64}{64}$=0.015mol,所以样品中铁和铜的物质的量之比n(Fe):n(Cu)=1:1,故答案为:1:1;
(2)根据铁守恒,滤液中亚铁离子来源于单质铁和铁离子,所以实验②的滤液中c(Fe2+)=$\frac{0.015mol+0.04mol}{0.04L}$=1.375 mol•L-1,故答案为:1.375 mol•L-1.
点评 本题考查混合物的计算,他们的浓重的,明确物质反应先后顺序及各组剩余固体成分是解本题关键,再结合转移电子守恒、原子守恒进行解答,同时考查学生思维缜密性.


科目:高中化学 来源: 题型:选择题
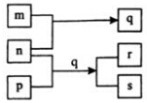 元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )
元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径的大小W<X<Z | B. | W的氧化物常温常压下为液态 | ||
| C. | Y的氧化物可能呈黑色或红棕色 | D. | Z的氧化物的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的聚沉是化学变化 | |
| B. | 含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目约为6.02×1021个 | |
| C. | 胶体的介稳性与胶体粒子直径大小有关 | |
| D. | NaCl晶体既可制成溶液又可制成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成amolA2,同时消耗2a molAB | |
| B. | 容器内,3种气体AB、A2、B2共存 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | AB的消耗速率等于A2的消耗速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
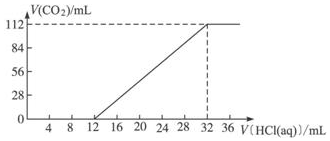 ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.
ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
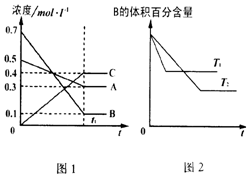
| A. | 在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动 | |
| B. | 保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| C. | T℃时,若由0.4mol•L -1A、0.4mol•L -1B、0.2mol•L -1C反应,达到平衡后,C的浓度为0.8mol•L -1 | |
| D. | 在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “PX”的化学式为C8H10,核磁共振氢谱图上有2组吸收峰 | |
| B. | “PX”能使酸性高锰酸钾溶液褪色,属于苯的同系物 | |
| C. | “PX”的一溴代物和二溴代物的同分异构体分别有1种、3种 | |
| D. | “PX”不溶于水,密度比水小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com