
 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:分析 由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的0.5倍.从200mL开始,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大时,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,
(1)由镁元素守恒计算;
(2)由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,再写离子反应;当加入NaOH溶液的体积大于200mL时,由图象可知,溶解Al(OH)3;
(3)加入NaOH溶液体积为200mL时,溶质为硫酸钠;
(4)沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(NaOH)=2n(Na2SO4)据此计算.
解答 解:由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的0.5倍.从200mL开始,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大时,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,
(1)据镁元素守恒,Mg(OH)2~Mg,镁的物质的量为0.15mol,
故答案为:0.15 mol;
(2)由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,离子反应为H++OH-=H2O;当加入NaOH溶液的体积大于200mL时,由图象可知,这是溶解Al(OH)3,离子反应为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:H++OH-=H2O;Al(OH)3+OH-=AlO2-+2H2O;
(3)当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,
故答案为:Na2SO4;
(4)沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(NaOH)=2n(Na2SO4)=2×0.25L×2mol/L=1mol,所以Na0H溶液的物质的量浓度为:$\frac{1mol}{0.2L}$=5 mol/L,
故答案为:5 mol/L.
点评 本题以图象题的形式考查混合物反应的计算,题目难度中等,正确分析图象中各阶段发生的反应为解答关键,注意守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
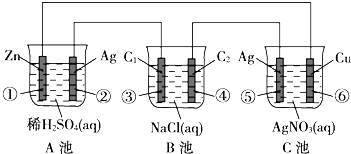 已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)
已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.
某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶于水时,HI分子比HCl分子更容易电离 | |
| B. | HI比HCl熔、沸点都高 | |
| C. | HI比HCl更稳定 | |
| D. | 拆开相同物质的量的HI分子比HCl消耗的能量小,HI是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①表示可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)中的△H大于0 | |
| B. | 图②是石墨为电极电解氯化钠稀溶液,阴、阳两极产生气体体积之比一定为1:1 | |
| C. | 图③表示25℃,0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,pH随加入酸体积的变化 | |
| D. | 图④表示2SO2(g)+O2(g)?2SO3(g)△H<0 正、逆反应平衡常数K随温度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
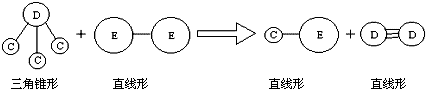
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量碳酸钠固体 | B. | 少量硫酸铜固体 | C. | 硝酸钾溶液 | D. | 氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
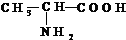 ,请回答下列问题.
,请回答下列问题. .
. 为:CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5.
为:CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)的键能之和大于2 mol SO3(g)的键能 | |
| B. | 一定量SO2(g)和O2(g)置于密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| C. | 恒温恒压下,在上述已达到平衡的体系中加入高效催化剂,SO2的转化率一定增大 | |
| D. | 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com