
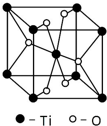
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、原溶液中的Br-不一定被氧化 |
| B、通入氯气之后原溶液中的Fe2+一定被氧化 |
| C、不能确定通入氯气之后的溶液中是否存在Fe2+ |
| D、若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正价或最低负价 | -4 | +4 |
| A、四种元素在化合物中具有一种相同的化合价,即+4 |
| B、高温下B可从C的氧化物中置换出C的单质 |
| C、四种元素的最高价含氧酸均为强酸 |
| D、只由非金属元素组成且含D元素的化合物中可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合前的醋酸约1%发生电离 |
| B、混合后的溶液中c(Na+)=c(CH3COO-) |
| C、氢氧化钠和醋酸的浓度不相等 |
| D、混合后的溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
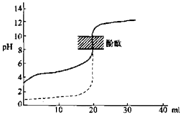 下列说法正确的是( )
下列说法正确的是( )| A、0.1 mol?L-1的Na2S溶液中c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| B、如图是用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和体积均相同的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、HA是酸性略强与醋酸的弱酸,在0.1 mol?L-1 NaA溶液中,离子浓度关系可能是c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
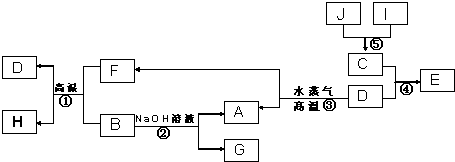
 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
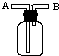
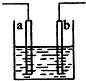 如图装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法正确的是( )
如图装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法正确的是( )| A、a、b不可能是同种材料的电极 |
| B、该装置可能是原电池,电解质溶液为稀盐酸 |
| C、该装置可能是a、b未形成闭合回路,电解质溶液是稀硝酸 |
| D、该装置可能是电解池,电解质溶液为稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com