
| A. | 聚丙烯的结构简式为: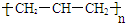 | B. | 苯分子的比例模型: | ||
| C. | 四氯化碳分子的电子式为: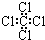 | D. | 乙烯的结构简式:CH2CH2 |
分析 A.聚丙烯的主链只有2个C;
B.比例模型主要体现的是组成该分子的原子间的大小关系;
C.CCl4为共价化合物,各原子满足8电子稳定结构;
D.乙烯中含有碳碳双键,官能团在结构简式中不能省略.
解答 解:A.聚丙烯为丙烯的加聚反应产物,聚丙烯正确的结构简式为: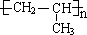 ,故A错误;
,故A错误;
B.比例模型主要体现的是组成该分子的原子间的大小关系,碳原子半径大于氢原子,所以苯的比例模型是 ,故B正确;
,故B正确;
C.CCl4为共价化合物,各原子满足8电子稳定结构,电子式为
D.乙烯中含有碳碳双键官能团,结构简式为CH2=CH2,故D错误,
故选B.
点评 本题主要考查了结构简式、电子式、比例模型、高聚物分子式的判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
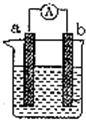 如图是某兴趣小组探究不同条件下化学能转变为电能的装置
如图是某兴趣小组探究不同条件下化学能转变为电能的装置查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
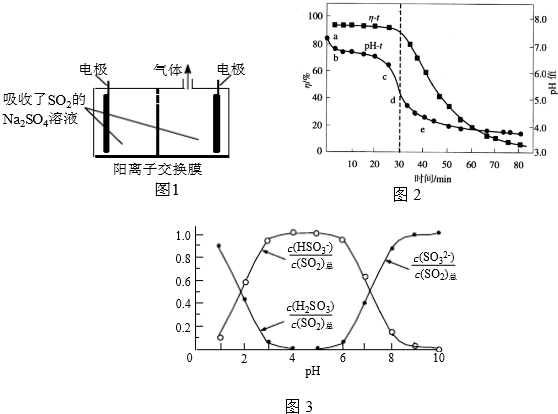
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | ③⑤ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(Fe)=0.5 mol•L-1•min-1 | B. | v(H2SO4)=1 mol•L-1•min-1 | ||
| C. | v(H2)=0.25 mol•L-1•min-1 | D. | v(FeSO4)=0.25 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池溶液中电解质能电离出自由移动的离子 | |
| B. | 有导线将两个活动性不同的电极连接 | |
| C. | 正极发生了氧化反应,负极发生了还原反应 | |
| D. | 电极上进行的氧化还原反应中有电子的转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
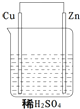 关于如图所示的原电池下列叙述正确的是( )
关于如图所示的原电池下列叙述正确的是( )| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com