
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是
A. 6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
B. 1LpH =1的H2SO4溶液中所含的H+数目为0.2NA
C. 标准状况下,22.4L的辛烷完全燃烧生成的CO2分子数为8NA
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×109NA
【答案】A
【解析】
A. 甲醛(HCHO)和醋酸的最简式均为CH2O,则6.0g甲醛(HCHO)和醋酸的混合物中含CH2O的物质的量为![]() = 0.2 mol,含有的原子个数为0.2mol×4×NA = 0.8NA,A项正确;
= 0.2 mol,含有的原子个数为0.2mol×4×NA = 0.8NA,A项正确;
B. pH =1的H2SO4溶液中,c(H+)=0.1mol/L,所以1L pH =1的H2SO4溶液中所含的H+数目为1L×0.1mol/L×NA =0.1NA,B项错误;
C. 辛烷在标准状况下为液体,22.4L辛烷的物质的量未知,所以无法求出辛烷完全燃烧生成的CO2分子数,C项错误;
D. 常温下,1L pH=9的CH3COONa溶液中溶质CH3COONa会发生水解生成醋酸与氢氧根离子, c(OH-) = ![]() =
= ![]() = 10-5 mol/L,即由水电离的氢氧根离子的个数为10-5 mol/L×1 L =1×105NA,发生电离的水分子数为1×105NA,D项错误;
= 10-5 mol/L,即由水电离的氢氧根离子的个数为10-5 mol/L×1 L =1×105NA,发生电离的水分子数为1×105NA,D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 | 450 | 500 | 550 | 600 |
SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
(1)由表中数据判断△H________0(填“>”、“=”或“<”)。
(2)能判断该反应是否达到平衡状态的是___________。
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO3的浓度不变 D. C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F. V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1。
①0-2min之间,O2的反应速率为____。
②此时的温度为____℃。
③此温度下的平衡常数为_____(可用分数表示)。
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将_________向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式如图所示,下列叙述正确的是

A.其分子式为C12H12O5
B.M中含有2种含氧官能团
C.M能够发生加成、取代和加聚反应
D.1 mol M和足量的NaOH溶液反应,可以消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法均可制得氯气:
①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
A. 6∶5∶6B. 1∶3∶5C. 15∶5∶3D. 1∶6∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | L层上有2对成对电子 |
请根据表中信息填空:
(1)A原子的核外电子排布式为___________。
(2)B元素在周期表中的位置:__________________;离子半径:B___ A(填“大于”或“小于”)
(3)C原子的价电子排布图是___________,其原子核外有__________个未成对电子,能量最高的电子为___________轨道上的电子,其轨道呈___________形。
(4)D原子的电子排布式为___________。D-的结构示意图是________________
(5)C、E元素的第一电离能的大小关系是___________(用元素符号表示)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是________________(用元素符号表示),CD3与水反应后的产物是__________和__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苹果酸(![]() )的说法正确的是
)的说法正确的是
A. 1mol苹果酸与足量金属Na反应生成1molH2
B. 苹果酸可发生酯化反应,消去反应,缩聚反应
C. 苹果酸能与H2发生加成反应
D. 1mol苹果酸可与3molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)碘水吸收二氧化硫的离子方程式为___。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:___。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量___(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如图流程图所示:
![]()
(4)写出步骤①中反应的化学方程式___。
(5)写出步骤②中反应的离子方程式___。
(6)该尾气中二氧化硫的体积分数为___(气体体积已换算成标准状况,用含有V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、Cl2反应合成氯化亚砜。发生如下反应:
①Cl2(g)+SO2(g)![]() SO2Cl2(g) △H =-471.7kJmol-1
SO2Cl2(g) △H =-471.7kJmol-1
②SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g) △H=-5.6kJmol-1
2SOCl2(g) △H=-5.6kJmol-1
567K时,在10L密闭容器中,充入一定量的Cl2、SO2和SCl2,测得初始压强为P0反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示,起始各组分及达平衡时SO2Cl2(g)的物质的量如表。

各组分 | Cl2 | SO2(g) | SCl2(g) | SO2Cl2(g) | SOCl2(g) |
起始/mol | 0.5 | 0.5 | 0.5 | 0 | 0 |
平衡/mol | 0.2 |
(1)图中数据显示0~l min体系压强增大的原因是____。
(2)反应①、②达到平衡时,SCl2的转化率为__。
(3)pK=-lgK,567K时,上述反应②的pK=___(结果保留两位有效数字,已知lg2=0.30)。
(4)567K下,若压缩容器体积为5L,则平衡时c(SO2)__(填“大于” “小于”或“等于”)上述反应平衡时的c(SO2)。
II.氯化亚砜常用于合成正丁酰氯。向连有尾气吸收装置的容器中按照物质的量1:1.5投料比加入正丁酸和氯化亚砜,反应为CH3CH2CH2COOH+SOCl2![]() CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
序号 | 实验方法 | 收率/% |
1 | 25℃,反应6h | 73.60 |
2 | 25℃,反应8h | 74.60 |
3 | 75℃,反应2h | 75.00 |
4 | 75℃,反应3h | 76.00 |
5 | 先25℃,反应1h;后75℃,反应0~1h | 81.10 |
6 | 先25℃,反应1h;后75℃,反应0~1h | 87.10 |
(5)若开始在较高温度下反应,则会放出大量气体。通过分析上表数据,选择合理实验方法的序号为___。说明你选用实验方法的理由:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
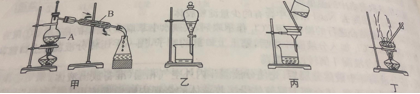
(1)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
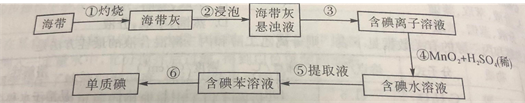
a.灼烧海带时,除需要三脚架外,还需要用到实验仪器是_____(填字母)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
b.步骤③的实验选择上述图_____(填“甲”“乙”或“丙”)装置。步骤⑤的实验操作名称是_____,选择上述图_____(填“甲”“乙”或“丙”)装置。步骤⑥的目的是从含碘苯溶液中分离出单子碘,同时回收苯,该步骤的实验操作名称是_____,选择上述图_____(填“甲”“乙”或“丙”)装置。
(2)某盐的混合溶液中含有Na+、Mg2+、Cl-、SO42-离子,测得Na+、Mg2+ 和Cl-的物质的量浓度依次为0.2molL-1、0.25molL-1、0.4molL-1,则c(SO42-)=_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com