
| A、能电离出H+的化合物叫做酸 |
| B、能电离出OH-的化合物叫做碱 |
| C、氧化物就是含有氧元素的化合物 |
| D、化合物分为酸、碱、盐和氧化物是用树状分类法分类的 |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
| A、控制温室气体排放,遏制全球变暧趋势是社会可持续发展的保证 |
| B、CH4是目前全球变暧的最主要的温室气体 |
| C、N2O不仅能引起温室效应还与臭氧层破坏、酸雨及化学烟雾有关 |
| D、为减少二氧化碳这种温室气体的排放,不使用含碳能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
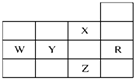
| A、W元素最高价含氧酸酸性强于Y元素最高价含氧酸酸性 |
| B、Z的阴离子电子层结构与R原子的相同 |
| C、p能级未成对电子数最多的是Z元素 |
| D、X元素是电负性最大的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
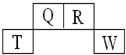 短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )| A、H2R2的分子中既含有极性共价键,又含有非极性共价键 |
| B、Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 |
| C、T的氧化物是一种良好的半导体材料 |
| D、Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:r(Y)>r(Z)>r(W) |
| B、元素Z、W形成的常见化合物中,阴、阳离子个数比相同 |
| C、元素Y 的简单气态氢化物的热稳定性比Z的强 |
| D、X、Y、Z三种元素形成的化合物只能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.48L | B、5.6L |
| C、8.4L | D、11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3是氧化剂 |
| B、3molCl2生成时有5mol电子转移 |
| C、KCl 是还原产物,Cl2是氧化产物 |
| D、被氧化与被还原的氯元素的质量比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2)?c(CO) |
| c(H2O) |
| n(CH4) |
| n(H2O) |
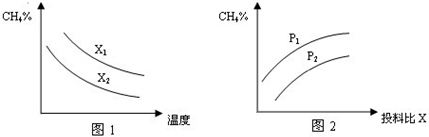
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com