
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
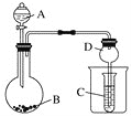
A. 若A为盐酸,B为碳酸钙,C中盛澄清石灰水,则C中先产生白色沉淀后沉淀又溶解
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
D. 实验仪器D可以起到防止溶液倒吸的作用
科目:高中化学 来源: 题型:
【题目】(1)同分异构现象在有机化合物中是非常普遍的。下列各组化合物:
①CH3CH2CH2CH3和(CH3)2CHCH3; ②CH3CH2OH和CH3CH2CH2OH;
③CH3COOCH2CH3和CH3CH2CH2COOH; ④CH3CH=CHCH3和CH3CH2CH=CH2;
⑤![]() 和
和![]() 。其中互为同分异构体的是______________________(填序号)。
。其中互为同分异构体的是______________________(填序号)。
(2)下列5种有机化合物:乙酸乙酯(CH3COOCH2CH3)、苯酚(![]() )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH)。
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH)。
①其中能与Na2CO3溶液反应产生气泡的是______________________。
②其中能与FeCl3溶液发生显色反应的是________________________。
③其中能发生银镜反应的是________________________。
④写出乙酸乙酯碱性条件水解反应的化学方程式____________________________。
(3)①蛋白质是维持生命的重要物质,它是由_____________________通过缩聚反应生成的一类高分子化合物;氨基酸因分子中含有的官能团是____________________和____________________,而具有__________________性。
②2008年,三鹿婴幼儿奶粉由于人为添加三聚氰胺,导致长期食用该奶粉的部分婴幼儿出现肾结石病。三聚氰胺的结构简式如下图所示。
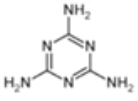
请你预测三聚氰胺在核磁共振氢谱图(1H核磁共振谱图)中会出现____________________个峰;三聚氰 胺中氮元素的质量分数为______________________(结果用百分数表示,并保留一位小数),添加三聚氰胺会使食品中蛋白质的含量虚高。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( )
A. CuS的溶解度大于PbS的溶解度
B. 原生铜的硫化物具有还原性,而铜蓝没有还原性
C. CuSO4与ZnS反应的离子方程式是Cu2++S2-===CuS↓
D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是()
A. 加入少量NaOH固体,钠离子和碳酸根离子浓度均增大
B. 将该溶液加水稀释,![]() 的比值保持不变
的比值保持不变
C. c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D. c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 0.18 mol·L-1 D. 0.24 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。
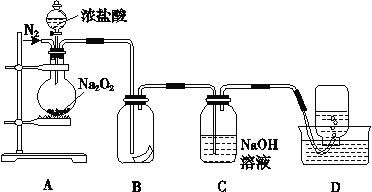
实验步骤及现象如下:
①检查装置气密性后,装入药品Na2O2并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸
入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条褪色,证明A中反应有______(填化学式)生成。若将B中红纸条改为湿润的紫石蕊试纸,现象为 _______
(2)实验前通N2的目的 ____,装置C的作用是_______
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,其不赞成的理由可能为: ①_______;②O2有可能是Na2O2与盐酸中的H2O反应所得.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4、H2O2在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要的氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式____________________,氧化产物与还原产物的物质的量之比为_______。
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_____ mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________(用文字表达),又变为棕黄色的离子方程式是_____________________。
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474 g KMnO4样品溶解酸化后,用0.100 mol·L-1标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在___(填“酸式”或“碱式”)滴定管中。配平上述反应的离子方程式:___MnO4-+___S2O32-+____H+=____Mn2++_____SO42-+____H2O,实验中,滴定至终点时消耗Na2S2O3溶液12.00 mL,则该样品中KMnO4的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com