
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源:不详 题型:填空题
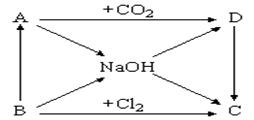
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
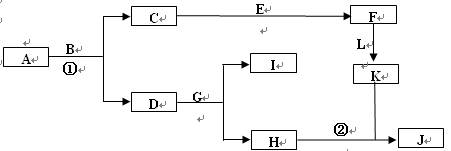
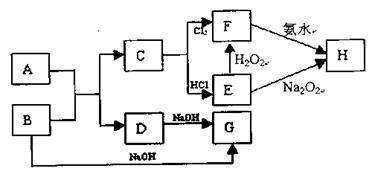
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 电离能/kJ·mol—1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 写出其一级电离方程式: 。
写出其一级电离方程式: 。 已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为: 。
已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为: 。 2YX3(g)在一定条件下达到平衡。
2YX3(g)在一定条件下达到平衡。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,说明硫酸具有还原性 |
| B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO4难溶于盐酸 |
| C.在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热,无红色沉淀,说明淀粉未水解 |
| D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com