
| A、0.04 |
| B、0.04mol/(L.s) |
| C、0.08mol(L.s) |
| D、0.04mol/L |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| A、0.l mol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、体积和pH都相同的NH4Cl溶液、盐酸,完全溶解少量且等质量的锌粉,前者所用时间少 |
| C、将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-a mol?L-1,若a>7时,则该溶液的pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源: 题型:
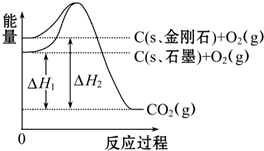
| A、C(s、石墨)═C(s、金刚石)△H=+1.9 kJ?mol-1 |
| B、石墨和金刚石的转化是物理变化 |
| C、金刚石的稳定性强于石墨 |
| D、1 mol石墨的能量比1 mol金刚石的总能量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 130℃ |
| 催化剂 |
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 具有多种同素异形体,形成的化合物种类繁多 |
| Y | 短周期主族元素中原子半径最大 |
| Z | 位于元素周期表金属与非金属元素的分界线上,最高化合价为+4 |
| W | 富集在海水中的元素,它的某些化合物常用作消毒刹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
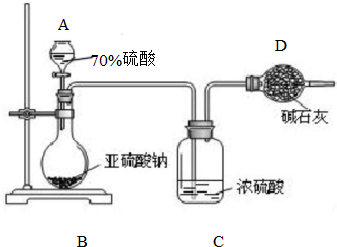 为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
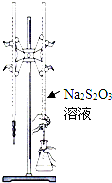 H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )
H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )| A、该滴定可用甲基橙做指示剂 |
| B、Na2S2O3是该反应的还原剂 |
| C、该滴定可选用如图所示装置 |
| D、该反应中每消耗2mol Na2S2O3,电子转移数为4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com