������̼��ˮ�г��˴���CO
2?CO
2��aq����CO
2��aq��+H
2O?H
2CO
3��aq��ƽ���⣬����������ƽ�⣺CO
2+H
2O?H
++HCO
3-��HCO
3-?H
++CO
32-������ѪҺ��pHͨ���ȶ���7.35��7.45��ҽѧ�ϳ�֮ΪѪҺ���ƽ�⣬���Ƕ������ع�ͬ���õĽ�����ó桢���ϵȶ�ҧ��ʱ����������ѪҺ��ע��һ�ֺ������ᣨ���ᣬHCOOH����Һ�壬ʹƤ���Ͼ�����С�壬������Ϊ����ѪҺ�е����ƽ�ⱻ�ƻ����£�
��1����ͬѧ��Ϊ���ܵ����϶�ҧʱ����ʱͿĨϡ��ˮ�����ˮ�����������ã���ͬ����һ�۵���
�����ͬ�⡱��ͬ�⡱��
��2�������£���0.10mol HCOONa��0.05mol HCl����ˮ���õ�1L��Һ���ټ���0.03mol NaOH����ʱ��Һ��n��HCOO
-��+n��OH
-��-n��H
+��=
mol
��3����֪25��ļ���ĵ���ƽ�ⳣ��K=1.8��10
-4��H
2CO
3�ĵ���ƽ�ⳣ��ΪK
1=4.4��10
-7��
K
2=4.7��10
-11������˵����ȷ����
��
A����̼������Һ�м��������Һ����������ʵ������
B��25��ʱ���������Һ�м���NaOH��Һ������ĵ���̶Ⱥ�Kֵ������
C����0.1mol?L
-1������Һ�м�������ˮ��
����
D����H
2CO
3��Һ�м���NaHCO
3���壬��Һ��pH����Һ�е�c��HCO
3-��������
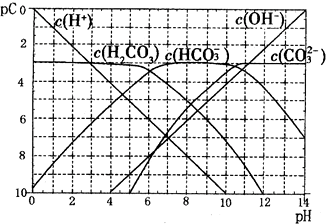
��4��pC����pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ö����ĸ�ֵ����ij��Һ��ij���ʵ�Ũ��Ϊ1��10
-3mol/L�������Һ�и����ʵ�pC=-lg��1��10
-3��=3����֪H
2CO
3��Һ�д��ڵĻ�ѧƽ�⣺CO
2+H
2O?H
2CO
3?H
++HCO
3-?2H
++CO
32-����ͼΪH
2CO
3��ҺpC-pHͼ����ش��������⣺
����pH=12ʱ��H
2CO
3��Һ����Ҫ���ڵĺ�̼������Ϊ
��
��pH��5ʱ����Һ��H
2CO
3��pC����Լ����3��ԭ����
��
��һ��Ũ�ȵ�NaHCO
3��Na
2CO
3�Ļ����Һ�����dz�Ϊ��������Һ������������Һ�м���������ǿ���ǿ���Һ��pH�仯����ѪҺ����ڵ�H
2CO
3-NaHCO
3������һ�֡�������Һ������ѪҺpH�����ȶ�����Ҫ���أ���c��H
+������ʱ��ѪҺ������H
+�����ӷ���ʽΪ
����c��OH
-������ʱ��ѪҺpHҲ�ܱ��ֻ����ȶ����Խ�ϵ��뷽��ʽ��Ҫ˵����
��

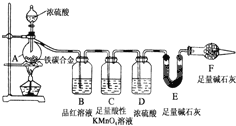 ��������̼����Ԫ����ɵĺϽ�ijʵ��С��Ϊ���о��úϽ�����ʲ��ⶨ�úϽ���̼���������������������ʵ��װ�ú�ʵ�鷽����
��������̼����Ԫ����ɵĺϽ�ijʵ��С��Ϊ���о��úϽ�����ʲ��ⶨ�úϽ���̼���������������������ʵ��װ�ú�ʵ�鷽����



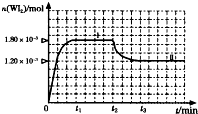 ±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺���о�±�ص��ʼ��仯���������Ҫ���壮
±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺���о�±�ص��ʼ��仯���������Ҫ���壮 ij�о���ѧϰС�����ⶨ�����£�25�桢101kPa��������Ħ���������ش��������⣮��С����Ƶļ�ʵ��װ����ͼ��ʾ��
ij�о���ѧϰС�����ⶨ�����£�25�桢101kPa��������Ħ���������ش��������⣮��С����Ƶļ�ʵ��װ����ͼ��ʾ��