
| A. | 稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓ | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 盐酸与饱和的澄清石灰水反应:H++OH-═H2O |
分析 A.稀硫酸和银不反应;
B.二者反应还生成弱电解质水;
C.钠投入硫酸铜溶液中时,Na先和水反应生成NaOH,NaOH再和硫酸铜发生复分解反应;
D.稀盐酸和氢氧化钙反应生成氯化钙和水,澄清石灰水写离子.
解答 解:A.稀硫酸和银不反应,所以没有离子方程式,故A错误;
B.二者反应还生成弱电解质水,离子方程式为2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O,故B错误;
C.钠投入硫酸铜溶液中时,Na先和水反应生成NaOH,NaOH再和硫酸铜发生复分解反应,离子方程式为2Na+2H2O+Cu2+=Cu(OH)2↓+H2↑+2Na+,故C错误;
D.稀盐酸和氢氧化钙反应生成氯化钙和水,澄清石灰水写离子,离子方程式为:H++OH-═H2O,故D正确;
故选D.
点评 本题考查离子方程式正误判断,为高频考点,明确离子反应实质、离子性质是解本题关键,知道哪些物质写化学式、哪些物质写离子,注意澄清石灰水写离子、石灰乳写化学式,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | A、Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | NH3$→_{催化剂△}^{O_{2}}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 | |
| D. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{NaOH(aq)}{→}$Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 存在于污水中的重金属离子,常用投加明矾等电解质的方法进行处理 | |
| C. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeBr2溶液中通入少量氯气:Br-+Cl2═Br2+2Cl- | |
| D. | SO2通入溴水中:SO2+Br2+2H2O═2H++SO42-+HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可以形成多种化合物,如NO、NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NO、NH3、N2H4、HCN、NH4NO3等. 2CO2+N2,反应过程中部分物质的浓度变化如图所示:
2CO2+N2,反应过程中部分物质的浓度变化如图所示: 2CO2+N2.
2CO2+N2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )
依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )| A. | 电极X的材料是Fe | |
| B. | 电解质溶液Y是AgNO3溶液 | |
| C. | 原电池工作时,X电极反应为:Fe-2e-=Fe2+ | |
| D. | 原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
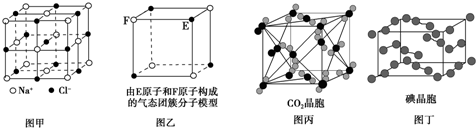
| A. | 在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体 | |
| B. | 该气态团簇分子(图乙)的分子式为E4F4或F4E4 | |
| C. | 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻 | |
| D. | 在碘晶体(图丁)中,碘分子的排列只有一种方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com