

| c(G) |
| c(OH-) |
| c(OH-) |
| c(H+) |

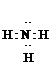 ,故答案为:S4N4;
,故答案为:S4N4;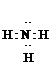 ;
;
| ||
| △ |
| ||
| △ |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
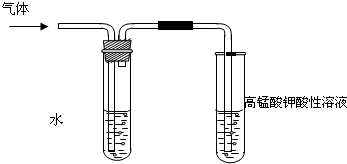 学习卤代烃的性质时,张老师通过实验的方法验证溴乙烷在不同溶剂中与NaOH 反应生成不同的反应产物,请你一起参与他们的探究.
学习卤代烃的性质时,张老师通过实验的方法验证溴乙烷在不同溶剂中与NaOH 反应生成不同的反应产物,请你一起参与他们的探究.查看答案和解析>>
科目:高中化学 来源: 题型:
 研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.
研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2、SiO2分别是碳酸和硅酸的酸酐 |
| B、CO2和SiO2与水反应分别生成相应的酸 |
| C、CO2是酸性氧化物,SiO2是两性氧化物 |
| D、CO2和SiO2都是由相应的分子组成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用活性炭去除冰箱中的异味 |
| B、用热碱水清除炊具上残留的油污 |
| C、用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
| D、用含硅胶、铁粉的透气小袋与食品一起密封包装 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com