
|
已知 98%的硫酸的物质的量浓度为1.84 mol/L,则49%的硫酸的物质的量浓度是 | |
| [ ] | |
A. |
小于 9.2 mol/L |
B. |
等于 9.2 mol/L |
C. |
大于 9.2 mol/L |
D. |
不能确定 |
科目:高中化学 来源: 题型:
 实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:| 浓H2SO4 |
| △ |
| 浓硫酸 |
| 140℃ |
| 浓硫酸 |
| 140℃ |
| ||
| ||
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
NaBr+H2SO4![]() NaHSO4+HBr
NaHSO4+HBr
CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
已知反应物的用量,NaBr(固体)0.3 mol,乙醇0.25mol,浓硫酸36 mL(98%,密度

图6-2
(1)仅用图6-2所示仪器安装制取和收集溴乙烷的装置,要求达到安全、损失少、不污染环境的目的,有关仪器的选择和连接顺序为(填数字)____________。
(2)写出不能选用的仪器(填仪器代码,如甲、乙……)及理由。
不能选用的仪器 | 理由 |
|
|
|
|
|
|
(3)反应时,若温度过高,可见有棕色气体产生,写出反应的化学方程式:_________。
(4)从棕黄色的粗溴乙烷制取无色的溴乙烷,应加入的试剂是_________,必须使用的仪器是_________。
(5)本实验的产率为60%,则可制取溴乙烷_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)反应时,若温度过高,可有红棕色气体产生,写出反应的化学方程式:_____________________________________。
(2)从棕黄色的粗溴乙烷制取无色的溴乙烷,应加入的试剂是____________,必须使用的仪器是__________________。
(3)本实验的产率为60%,则可制取溴乙烷____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
溴乙烷是一种难溶于水的无色液体,密度约为水的1.5倍,沸点为38.4 ℃。实验室制取溴乙烷的反应如下:
NaBr+H2SO4![]() NaHSO4+HBr
NaHSO4+HBr
CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
已知反应物的用量,NaBr(固体)0.3 mol,乙醇0.25mol,浓硫酸36 mL(98%,密度1.84 g·cm-3),水25 mL,其中乙醇的密度约为水的密度的4/5。试回答:

图6-2
(1)仅用图6-2所示仪器安装制取和收集溴乙烷的装置,要求达到安全、损失少、不污染环境的目的,有关仪器的选择和连接顺序为(填数字)____________。
(2)写出不能选用的仪器(填仪器代码,如甲、乙……)及理由。
| 不能选用的仪器 | 理由 |
(3)反应时,若温度过高,可见有棕色气体产生,写出反应的化学方程式:_________。
(4)从棕黄色的粗溴乙烷制取无色的溴乙烷,应加入的试剂是_________,必须使用的仪器是_________。
(5)本实验的产率为60%,则可制取溴乙烷_________g。
查看答案和解析>>
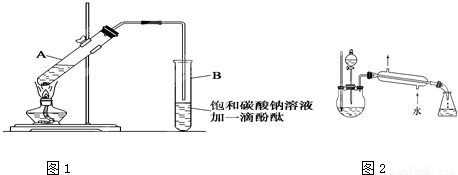
科目:高中化学 来源:2011年高考化学一轮复习:《饮食中的有机化合物》(解析版) 题型:解答题
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com