
| A. | 100 mL 0.2 mol/L的NaCl溶液 | B. | 100 mL 0.1 mol/L的NaCl溶液 | ||
| C. | 25 mL 0.2 mol/L的Na2SO4溶液 | D. | 50 mL 0.1 mol/L的NaHCO3溶液 |
分析 钠离子的物质的量浓度与溶液体积大小无关,与硫酸钠的化学式及其浓度有关,如:50mL 0.1mol/L的Na2CO3溶液中Na+的物质的量浓度为:0.1mol/L×2=0.2mol/L,据此进行解答.
解答 解:50mL 0.1mol/L的Na2CO3溶液中Na+的物质的量浓度为:0.1mol/L×2=0.2mol/L,
A.100 mL 0.2 mol/L的NaCl溶液中钠离子的浓度为0.2mol/L,故A正确;
B.100 mL 0.1 mol/L的NaCl溶液中钠离子的浓度为0.1mol/L,故B错误;
C.25 mL 0.2 mol/L的Na2SO4溶液中钠离子的浓度为:0.2mol/L×2=0.4mol/L,故C错误;
D.50mL 0.1 mol/L的NaHCO3溶液中钠离子的浓度为0.1mol/L,故D错误;
故选A.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的浓度的概念及表达式为解答关键,注意离子的浓度与溶液体积大小无关,为易错点,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈酸性说明草酸是弱酸 | B. | c(K+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-) | ||
| C. | c(K+)>c(HC2O4-)>c(C2O42-)>c(H+) | D. | c(H2C2O4)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的简单气态氢化物在一定条件下可被Q单质氧化 | |
| B. | Y的简单离子半径小于Z的简单离子半径 | |
| C. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 | |
| D. | Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
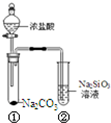
| A. | 向Na2SiO3溶液中滴入酚酞溶液无明显现象 | |
| B. | 试管①中反应的离子方程式是:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 该实验可以证明酸性:盐酸>碳酸>硅酸 | |
| D. | 若将盐酸换成硫酸,能证明酸性:硫酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 1-已醇的沸点比已烷的沸点高89℃ | 1-已醇和已烷可通过蒸馏初步分离 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | H2SO4是离子化合物 | 硫酸溶液可导电 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
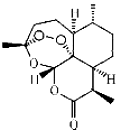 屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )
屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )| A. | 青蒿素是无机物 | |
| B. | 青蒿索的摩尔质量为282 | |
| C. | 屠呦呦发现用乙醚提取青蒿素效果很好,表明青蒿素难溶于水,易溶于乙醚,在水中溶解度不大 | |
| D. | 屠呦呦获得的是诺贝尔生理学或医学奖,说明无需学好化学,也能在医学上取得非凡的成绩 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
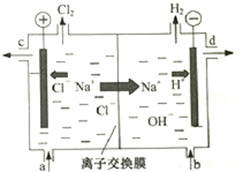 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.| K1 | K2 | |
| H2SO3 | 1.54x 10-2 | 1.02x 10-7 |
| HClO | 2.95x 10-8 | |
| H2CO3 | 4.3x 10-7 | 5.6x 10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com