
科目:高中化学 来源: 题型:阅读理解
 (2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
(2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
| ||
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是
做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是查看答案和解析>>
科目:高中化学 来源: 题型:
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.因为醋酸是弱电解质,盐酸是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少
C.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等
D.物质的量浓度相同的磷酸钠溶液和磷酸溶液中![]() 的物质的量浓度相同
的物质的量浓度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应可制备氧气。
①取等物质的量浓度等体积溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
| 序号 | 条件 | 现象 | 结论 | |
| 1 | 温度/℃ | 催化剂 | ||
| 2 | 40 | FeCl3溶液 |
|
|
| 3 | 20 | FeCl3溶液 |
|
|
| 4 | 20 | MnO2 |
|
|
| 5 | 20 | 无 |
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
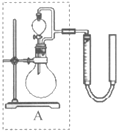
②实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。
(2)Na2O2与水反应也可生成O2。某同学取4 g Na2O2样品与过量水反应,待反应完全终止时,得100 mL溶液X和448 mL O2(已折算为标准状况)。该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究。
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀。则反应的离子方程式是 。
②通过如上图所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应。取25 mL X,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56 mL O2(已折算为标准状况),则此样品中:Na2O2的质量分数是 。
查看答案和解析>>
科目:高中化学 来源:北京市西城区2010年高三一模(理科综合)化学部分 题型:实验题
(14分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应 可制备氧气。
可制备氧气。
①取等物质的量浓度等体积 溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
|
序号 |
条件 |
现象 |
结论 |
|
|
1 |
温度/℃ |
催化剂 |
||
|
2 |
40 |
FeCl3溶液 |
|
|
|
3 |
20 |
FeCl3溶液 |
|
|
|
4 |
20 |
MnO2 |
|
|
|
5 |
20 |
无 |
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
②实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。

(2)Na2O2与水反应也可生成O2。某同学取4 g Na2O2样品与过量水反应,待反应完全终止时,得100 mL溶液X和448 mL O2(已折算为标准状况)。该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究。
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀。则反应的离子方程式是 。
②通过如上图所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应。取25 mL X,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56 mL O2(已折算为标准状况),则此样品中:Na2O2的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com