
【题目】已知B的原子序数是x,B2-与A3+具有相同的电子层结构,则A元素的原子序数为( )
A. x-5B. x+5C. x+1D. x-1
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是35%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增大C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
![]()
A. 原子半径:r(W)>r(Z)>r(Y)>r(X)
B. Y元素的单质只能跟酸反应,不能跟碱反应
C. 最简单气态氢化物的热稳定性:W>Z
D. W元素的各种氧化物对应的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知:![]() ]。下列叙述不正确的是
]。下列叙述不正确的是

A. Ka(HA) = 10-4.76
B. 滴加NaOH溶液过程中,![]() 保持不变
保持不变
C. m点所示溶液中:c(H+) = c(HA)+c(OH-)-c(Na+)
D. n点所示溶液中可能:c((Na+) = c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应:A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A的体积分数不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧ B. ①⑥ C. ②④ D. ③⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产生活中氮及其化合物的应用和处理已引起广泛关注。
(1)合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________,则该条件下反应的平衡常数为________。
2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________,则该条件下反应的平衡常数为________。

A.活塞不再移动 B.容器内气体压强不再改变
C.容器内气体密度不再改变 D.容器内气体的平均分子质量不再改变
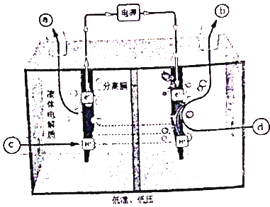
(2)研究者通过探索,发现利用反向燃料电池可以在温和的条件下将电解水制氢与氮、氢反应制氨合并(即将电解产生的活性氢作为中间产物直接还原氮气),其工作原理示意图如下:写出阴极电极方程式________。
(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g),
4N2(g)+6H2O(g),
①已知4NH3(g)+ 3O2(g)![]() 2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
N2(g)+ O2(g)![]() 2NO(g) ΔH2 = +180.8 kJ/mol
2NO(g) ΔH2 = +180.8 kJ/mol
则反应4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g)的ΔH = ________。
4N2(g)+6H2O(g)的ΔH = ________。
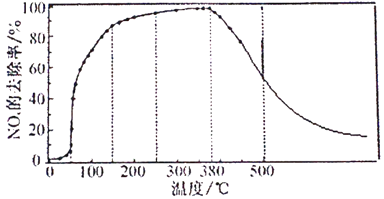
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应容器中反应10时测得NOx的去除率随反应温度的变化曲线如下图所示,请解释当反应温度高于380℃时NOx的去除率随温度升高先迅速下降后缓慢下降的原因________。
③请在下图中画出反应8min时NOx的去除率随温度变化的曲线。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中主要存在下列离子,试判断该溶液的溶质并写出其电离方程式:
(1)H+、CH3COO-_____________、_____________________。
(2)Fe3+、SO42-_____________、_______________________。
(3)Na+、HCO3-_____________、_______________________。
(4)H+、HS-、S2-_____________、______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季是雾霾高发季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NOX可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_______________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
N2(g)+2CO2(g)△H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
c(CO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(CO)=V(CO2)
②此条件下达到平衡时,计算该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有_____________________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2和氮的氧化物气体(NOx),请写出氢氧化钠溶液吸收NO和NO2(两者体积比1:1)的离子方程式 ___________________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。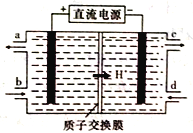
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com