
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于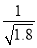 ×10-11mol·L-1
×10-11mol·L-1
科目:高中化学 来源:2015-2016学年陕西省高一上学期期中测试化学试卷(解析版) 题型:填空题
(1)黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被还原的元素是 ,被氧化的元素是 ,氧化剂是 ,还原剂是 。
(2)将饱和FeCl3溶液滴入沸水中,继续煮沸至液体变为________色,即可得到Fe(OH)3胶体。向其中逐滴加入稀硫酸至过量,现象是 ,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省金兰教育合作组织高一上学期期中联考化学试卷(解析版) 题型:选择题
同温同压下,等质量的O2和O3相比较,下列结论正确的是
A.它们的分子数目之比是 1:1 B.它们的氧原子数目之比为 2:3
C.它们的密度之比为 2:3 D.它们的体积之比是 1:1
查看答案和解析>>
科目:高中化学 来源:2016届广东省惠州市高三上学期第二次调研测试化学试卷(解析版) 题型:选择题
X、Y、M、N是短周期且原子序数依次增大的主族元素。已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大。下列有关说法正确的是
A. M、N的简单离子半径: r(N-)>r(M2﹣)
B. 气态氢化物的稳定性:M>X
C. X、Y形成的化合物中只有离子键
D. X、Y、N所形成化合物的水溶液可能显中性或碱性
查看答案和解析>>
科目:高中化学 来源:2016届广西省钦州市钦南区高三上学期期中质量调研测试化学试卷(解析版) 题型:选择题
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法正确的是
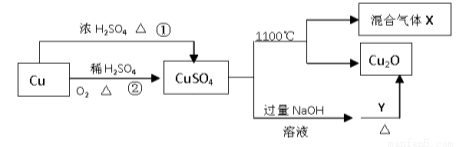
A.途径①和途径②都体现了硫酸的酸性和氧化性
B.Y可以是酒精溶液
C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
D.将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:推断题
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(水及部分产物已略去)。

(1)若X为常见金属单质,W是某强酸的稀溶液。写出Y与X反应生成Z的化学方程式为________________。
(2)若X为非金属单质,W是空气的主要成分之一。实验室制取气体Y的离子方程式为__________________。
(3)若X、Y均为铝盐,X的水溶液显酸性。请写出Z转化为Y的离子方程式:_ _____。
(4)若X为一元强碱,常温下W为无色气味的气态氧化物。请写出Z转化为Y的化学方程式:__ _____。
查看答案和解析>>
科目:高中化学 来源:2016届广东省东莞市六校高三上学期联考理综化学试卷(解析版) 题型:选择题
下列关于元素及其化合物的说法正确的是( )
A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应
B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同
C.Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3
D.制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第二次模拟化学试卷(解析版) 题型:选择题
化学在工业生产和日常生活中有着重要的应用。下列说法正确的是
A.CO2、NO2和SiO2都是酸性氧化物,都是大气污染物
B.Na2O2、H2O2所含化学键完全相同,都能作供氧剂
C.常温下,浓硫酸、浓硝酸与铁均能发生钝化,均能用铁罐储运
D.NaClO和明矾都能作消毒剂或净水剂,加入酚酞试液均显红色
查看答案和解析>>
科目:高中化学 来源:2016届四川省自贡市高三上第一次诊断考试理综化学试卷(解析版) 题型:填空题
有X、Z、W三种含14个电子的粒子,其结构特点如下:
粒子代码 | X | Z | W |
原子核数目 | 单核 | 同元素构成的两核 | 同元素构成的两核 |
粒子的电性 | 电中性 | 两个负电荷 | 电中性 |
(1)X的氧化物晶体中含有化学键类型是_____________。
(2)Z与钙离子组成的化合物的电子式为_____________。
(3)组成W的元素的简单氢化物极易溶于水的主要原因是 ,该氢化物与空气可以构成一种燃料电池,产物为无毒物质,电解质溶液是KOH溶液,其负极的电极反应式为____ 。在常温下,用该电池电解1.5 L 1mol/LNaCl溶液,当消耗标准状况下1.12LW的简单氯化物时,NaCl溶液的pH=
(假设电解过程中溶液的体积不变)。
(4)M原子核外比X原子多2个电子。可逆反应2MO2(气)+O2(气)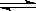 2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
(5)欲比较X和M两元素的非金属性相对强弱,可采取的措施有 (填序号)。

a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com