
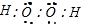 ,
,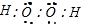 ;
;| ①×3-【②+③×2】 |
| 6 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 1215.9MPa,473K |
| A、黑磷与白磷互为同分异构体 |
| B、黑磷和白磷均不能导电 |
| C、白磷转化为黑磷是氧化还原反应 |
| D、白磷转化为黑磷是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
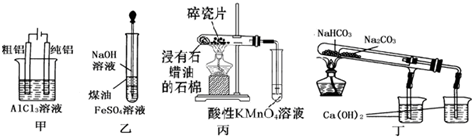
| A、用甲图装置电解精炼铝 |
| B、用乙图装置制备Fe(OH)2 |
| C、丙图装置酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
| D、用丁图装置验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、该反应中的氧化剂是SiO2,还原剂为C |
| B、该反应中的氧化产物和还原产物的物质的量之比为1:2 |
| C、该反应中转移的电子数为12e- |
| D、该反应中的还原产物是SiC、氧化产物是CO,其物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用激光笔鉴别淀粉溶液和蔗糖溶液 |
| B、用过量的KSCN溶液除去FeCl2溶液中的少量FeCl3 |
| C、通过灼热的镁粉,可以除去N2中的少量O2 |
| D、用溶解、过滤的方法可分离Na2SO4和NaCl固体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
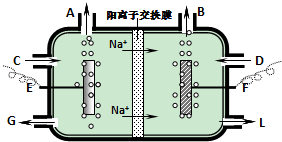
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O |
| B、漂白粉溶液中通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO+CO32- |
| C、FeBr2溶液中加入过量的氯水:2Br-+Cl2═Br2+2Cl- |
| D、澄清的石灰水中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com