
分析 (1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,能使湿润红色石蕊试纸变蓝色的气体是氨气,根据元素守恒知生成的酸式盐为碳酸氢钠;
(2)NaCN是强碱弱酸盐,氢氰根离子水解导致溶液呈碱性;
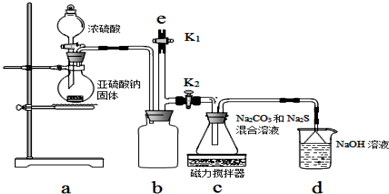
【一】a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气.
(3)a装置中盛Na2SO3固体的仪器名称是圆底烧瓶;
(4)d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成;
(5)验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收;
【二】(6)根据溶度积常数知,银离子先和CN-反应后和I-反应,Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点;
(7)计算消耗硝酸银物质的量,再根据方程式Ag++2CN-=[Ag(CN)2]-计算出氰化钠的含量.
解答 解:(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,能使湿润红色石蕊试纸变蓝色的气体是氨气,根据元素守恒知生成的酸式盐为碳酸氢钠,反应方程式为NaCN+H2O2+H2O=NH3+NaHCO3,
故答案为:NaCN+H2O2+H2O=NH3+NaHCO3;
(2)NaCN是强碱弱酸盐,CN-离子水解生成OH-显碱性,水解离子方程式为CN-+H2O?HCN+OH-,
故答案为:碱性;CN-+H2O?HCN+OH-;
(3)该仪器名称是圆底烧瓶,故答案为:圆底烧瓶;
(4)d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成,
故答案为:Na2SO3;
(5)验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收,
故答案为:NaOH溶液;
(6)Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点,
故答案为:滴入最后一滴硝酸银溶液,出现淡黄色沉淀;
(7)消耗AgNO3的物质的量为:2.5×10-3L×0.0001mol/L=2.50×10-7mol,根据方程式Ag++CN-=AgCN↓,处理的废水中氰化钠的质量为2.50×10-7mol×49g/mol=1.225×10-5g,废水中氰化钠的含量为:$\frac{1.225×1{0}^{-2}mg}{0.025L}$=0.49mg/L<1mg/L,所以已达标,
故答案为:是.
点评 本题考查物质制备实验、物质含量测定等知识,题目难度中等,试题综合性较强,关键是对原理的理解,注意制备中渗入环保意识,熟练掌握元素化合物知识与实验制备基本原则,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
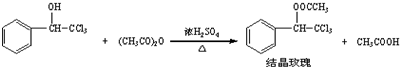
| 三氯甲基苯基甲醇 | 无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 白色至微黄色晶体.不溶于水,溶于乙醇.熔点:88℃ |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
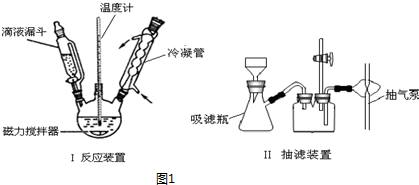
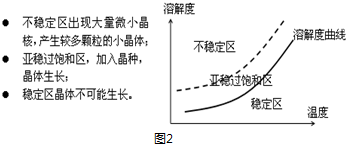
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
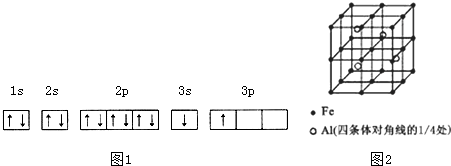
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com