
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,71gCl2溶于足量水,所得溶液中Cl2、HClO和ClO-三种微粒总数为NA
B.pH=2的CH3COOH溶液中,H+的数目为0.01NA
C.将5.6g铁块投入一定量的稀硝酸中,恰好完全反应,一定转移0.3NA个电子
D.用电解法精炼铜时,若电路中转移2mol电子,阳极质量减轻64g
【答案】A
【解析】
A. 标准状况下,71gCl2物质的量为1mol,溶于足量水,Cl2 +H2O ![]() HCl + HClO,反应的氯气和未反应的氯气共1mol,反应的氯气与生成的HClO之比为1:1,根据守恒,则生成的HClO与未反应的氯气微粒总数为NA,由因HClO
HCl + HClO,反应的氯气和未反应的氯气共1mol,反应的氯气与生成的HClO之比为1:1,根据守恒,则生成的HClO与未反应的氯气微粒总数为NA,由因HClO ![]() H+ + ClO-,根据物料守恒,电离生成的ClO-、未电离的HClO和未反应的氯气微粒总数等于NA,故A正确;
H+ + ClO-,根据物料守恒,电离生成的ClO-、未电离的HClO和未反应的氯气微粒总数等于NA,故A正确;
B. pH=2的CH3COOH溶液中,由于没有溶液体积,因此H+的数目无法计算,故B错误;
C. 5.6g铁块即物质的量为0.1mol,将铁投入一定量的稀硝酸中,恰好完全反应,铁可能变为+2价,也可能变为+3价,因此转移电子数目在0.2NA到0.3NA之间,包括端点值,故C错误;
D. 用电解法精炼铜时,若电路中转移2mol电子,阳极是锌、铁、铜在失去电子,因此质量减轻具体多少,无法计算,故D错误。
综上所述,答案为A。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.1.6g-NH2和1.5g-CH3含有的电子数均为NA
B.44 g CO2和N2O的混合物中含有的氧原子数为1. 5NA
C.精炼铜,若阳极失去2NA个电子,则阴极增重64 g
D.60 g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C—O键数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y在医药上具有广泛用途,可由X制得。下列有关化合物X、Y的说法正确的是( )

A.X分子中所有原子可能在同一平面上
B.1molY最多能与1molNaOH反应
C.X、Y均能与酸性KMnO4溶液反应
D.X、Y分别与足量H2加成的产物分子中手性碳原子数目不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质碳酸钙是一种广泛应用的工业填料,主要用于塑料、造纸、橡胶和涂料等。工业上以磷石膏(主要成分为CaSO4,杂质主要是SiO2、FeO、Fe2O3、Al2O3等)为原料制备轻质碳酸钙。已知碳酸钙的溶解度比硫酸钙的溶解度小,在一定温度下,钙离子开始沉淀的pH值为12.3,氢氧化铝开始溶解的pH值为12.0,其他金属离子形成氢氧化物沉淀的相关pH的范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Al3+ | 3.0 | 4.7 |
制备流程如图:

请问答:
(1)以下说法正确的是__。
A.溶解的过程中,可以用盐酸代替硝酸
B.滤渣1的主要成分是SiO2,滤渣2的上要成分是Fe(OH)3、Al(OH)3
C.转化时,可以先通氨气至饱和后再通过量二氧化碳,以提高钙离子的转化率
D.转化时可以适当加热,以加快反应速率
E.洗涤时可以采用滤液3
(2)调节溶液pH范围时,最佳的pH范围是__,理由是__。
(3)碳酸钙产品中钙含量的测定:
用电子天平准确称量产品2.000g于干净的烧杯中,滴加2mol/L的盐酸恰好完全溶解,加蒸馏水继续蒸发除去过量的酸至pH=6~7,转移至250mL的容量瓶中,定容摇匀。用移液管准确移取25.00mL溶液于锥形瓶中,加入NaOH溶液10mL,摇匀,加入钙指示剂30mg,用已标定的EDTA(乙二胺四乙酸,可以表示为H4Y)标准溶液进行滴定。
已知:Ca2++Y4-=[CaY]2-,测定数据如下:
待测产品溶液体积(mL) | 消耗EDTA标准溶液体积(mL) | EDTA标准溶液的浓度(mol) | |
1 | 25.00 | 14.90 | 0.1121 |
2 | 25.00 | 16.72 | 0.1121 |
3 | 25.00 | 15.00 | 0.1121 |
4 | 25.00 | 15.10 | 0.1121 |
①进行整个滴定操作实验的过程中,下列操作方法正确的是__。
A.使用移液管移取溶液的时候,移液管尖嘴不能接触容器壁
B.滴定管水洗后,需要用标准溶液润洗3次,再排出气泡,使液面位于“0”刻度或“0”刻度以下
C.滴定管调液面后,需静置1~2min,再进行读取刻度数据进行记录
D.电子天平读数时,两边侧面应同时处于打开状态,使空气保持流通
②该产品中钙元素的质量分数为__(保留两位有效数字),若滴定结束时仰视读数,则测定的结果__(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.等质量的甲烷和乙酸分别充分燃烧,消耗氧气的量相同
B.麦芽糖分子式为C12H22O11,能发生银镜反应
C.用新制氢氧化铜溶液可鉴别丙酸和丙醛两种无色液体
D.油脂的硬化反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中进行可逆反应2NO2(g)![]() 2NO(g)+O2(g),下列可以作为反应达到化学平衡状态标志的有( )
2NO(g)+O2(g),下列可以作为反应达到化学平衡状态标志的有( )
A.单位时间内生成nmolO2的同时生成2nmolNO
B.NO2、NO、O2的物质的量之比为2:2:1的状态
C.密闭容器中压强不再改变的状态
D.密闭容器中气体的密度不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两种硫酸盐按一定比例混合后共熔,可制得化合物M(化学式为xK2SO4·yCr2(SO4)3),若将2.83g化合物M中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr2O72-+3I2+7H2O,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀。
由此推断出化合物M中x:y为__。写出简要计算过程:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z)互为同分异构体,下列说法不 正确的是
(z)互为同分异构体,下列说法不 正确的是
A.z 的二氯代物有三种
B.x、y、z 中只有 x 的所有原子可能处于同一平面
C.x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
D.x、y 的一氯代物均只有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷主要用于汽油抗爆剂的添加剂,还可用作有机合成和蒸熏消毒用的溶剂。实验室用乙醇、浓硫酸制备乙烯并合成1,2-二溴乙烷,反应原理为:CH2 = CH2 + Br2→CH2BrCH2Br,反应装置如图(加热装置省略)。
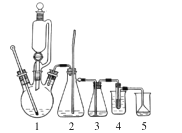
实验步骤:
①如图组装好仪器,在冰水冷却下,将 24 mL 浓硫酸缓慢加入到 12 mL 乙醇中,混合均匀后取 6 mL 加入到三颈烧瓶中,剩余部分倒入恒压滴液漏斗中。
②取一支 20 mL 的吸滤管,量取 3.0 mL(0.1 mol)液溴倒入吸滤管中,再加入 3~5 mL 水,将吸滤管放入 4 的烧杯中。
③加热装置 1 前,先切断装置 3 与 4 的连接处,待温度上升到约 120 ℃时,大部分空气已被排出,然后连接 3 与 4,待温度上升到约 170 ℃时有乙烯产生,开始缓慢滴加乙醇-硫酸混合液,并维持温度在 170~200 ℃左右,当溴的颜色全部褪去,反应即告结束。
④反应完成后,先取下吸滤管,再停止加热。将产物转移至分液漏斗中,依次以等体积的水、1%氢氧化钠水溶液各洗一次,再用水洗两次至中性。加入适量无水氯化钙干燥粗产品,过滤、蒸馏,收集 129~132℃的馏分,产量 5.7g。回答下列问题:
(1)乙烯与溴的反应类型为 _______反应,组装好仪器后必须先 _____________。
(2)装置 1 为乙烯发生器,反应中浓硫酸的作用是 ____________________。
(3)装置 2 为安全瓶,若系统发生堵塞,2 中的现象为 ____________________。
(4)制备乙烯时,常伴有乙醇被氧化的副反应,生成二氧化碳、二氧化硫等气体、则装置 3 洗气瓶中的试剂为________,若去掉装置3,则装置 4 中可能发生的副反应的化学方程式为 ___________________。
(5)若 1 中滴速过快,可能产生的影响为乙烯来不及与溴反应而跑掉,同时也会带走一部分溴进入装置 5(5% 氢氧化钠溶液),降低产率。装置4吸滤管中加水的目的是________。已知该条件下溴与NaOH 反应的氧化产物只有NaBrO3,写出该反应的离子方程式 _____________。
(6)计算本实验的产率:______________ (保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com