
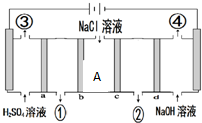
| A. | a和c为阳离子交换膜,b和d为阴离子交换膜 | |
| B. | ③与④两种气体体积比为1:1 | |
| C. | ①处生成的物质为氢氧化钠 | |
| D. | 当转移2mol e-时,A处减少离子数为2NA |
分析 图中左边电极与正极相连为阳极,右边电极为阴极,阴离子向阳极移动,即向右移动,阳离子向阴极移动,即向左移动;氢离子透过a,氯离子透过b,二者在ab之间形成盐酸,则①处生成的物质为盐酸;钠离子透过c,氢氧根离子透过d,二者在cd之间形成NaOH,则②处生成的物质为氢氧化钠;右边电极为阴极,氢离子得电子生成氢气,左边电极为阳极,氢氧根离子失电子生成氧气,据此分析.
解答 解:图中左边电极与正极相连为阳极,右边电极为阴极,阴离子向阳极移动,即向右移动,阳离子向阴极移动,即向左移动;氢离子透过a,氯离子透过b,二者在ab之间形成盐酸,则①处生成的物质为盐酸;钠离子透过c,氢氧根离子透过d,二者在cd之间形成NaOH,则②处生成的物质为氢氧化钠;右边电极为阴极,氢离子得电子生成氢气,左边电极为阳极,氢氧根离子失电子生成氧气,
A.由分析可知,氢离子透过a,钠离子透过c,则a和c为阳离子交换膜,氯离子透过b,氢氧根离子透过d,则b和d为阴离子交换膜,故A正确;
B.右边电极为阴极,氢离子得电子生成氢气,则④生成的气体为氧气,左边电极为阳极,氢氧根离子失电子生成氧气,则③生成的气体为氢气,则③与④两种气体体积比为2:1,故B错误;
C.由分析可知,①处生成的物质为盐酸,故C错误;
D.当转移2mole-时,A处向左移动的阳离子钠离子减少2mol,向右移动的氯离子减少2mol,所以A处减少离子数为4NA,故D错误.
故选A.
点评 本题考查电解池的工作原理,涉及阴阳极的判断、阴阳离子的移动方向、阴阳离子交换膜等,题目难度较大,侧重于考查学生的分析能力和对基础知识的综合应用能力.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:多选题
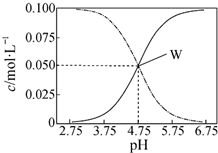
| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| D. | 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)═c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,若1mol氢原子所具有的能量为E1,1mol氢分子具有的能量为E2,则2E1>E2 | |
| B. | 已知4A(g)+5B(g)?4C(g)+6D(g)△H<0,向平衡容器里继续加入A和B,△H会减小 | |
| C. | 浓硫酸用水稀释过程是放热的,所以稀释浓硫酸是一个放热反应. | |
| D. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是放热反应 | |
| B. | 该反应是吸热反应 | |
| C. | 开始时该反应吸热,后来该反应放热 | |
| D. | 上述观点都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂是HCl,氧化剂是KMnO4 | |
| B. | 每生成1mol Cl2转移电子的物质的量为2mol | |
| C. | 氧化剂与还原剂的物质的量之比为1:8 | |
| D. | 氧化产物与还原产物的物质的量之比为5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
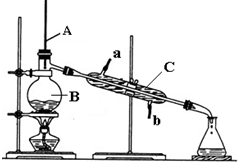 工业酒精是含水约4%的液态乙醇,已知CaO和Ca(OH)2均不溶于乙醇.实验室可用如图所示的装置除去工业酒精中的水,请回答下列各问题.
工业酒精是含水约4%的液态乙醇,已知CaO和Ca(OH)2均不溶于乙醇.实验室可用如图所示的装置除去工业酒精中的水,请回答下列各问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④ | C. | ①③④ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com