
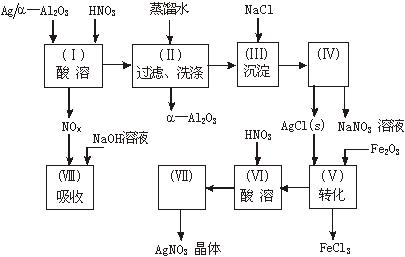
阅读上述实验流程,完成下列填空:
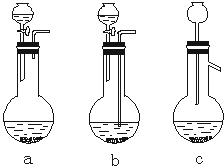
(1)Ag/α-Al2O3加酸溶解应该选用装置 (选填a、b、c)。
(2)在实验操作(Ⅱ),如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式
。
(3)实验操作(Ⅳ)所需玻璃仪器为 (填写三种)。
(4)实验操作(Ⅶ)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为: (多选扣分)。
(a)蒸馏 (b)蒸发 (c)灼烧 (d)过滤 (e)冷却结晶
(5)已知:NO+NO2+2NaOH![]() 2NaNO2+H2O;
2NaNO2+H2O;
2NO2+2NaOH![]() NaNO3+NaNO2+H2O
NaNO3+NaNO2+H2O
NO和NO2的混合气体的组成可表示为NOx。该混合气体通入NaOH溶液被完全吸收时,x的值为
。
(a)x≤1.5 (b)x=1.2 (c)x≥1.5
(6)已知Ag/α—Al2O3中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为 和
。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
(1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是某同学对相应反应的离子方程式所作的评价,其中评价完全合理的是( )
|
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
| ag CuO、Al2O3、MgO组成的混合物全部溶于20 mL某酸溶液,反应后向所得溶液中加入10 mL氢氧化钠溶液,得到的沉淀量最大。则下列选项正确的是 | |||||||||||||||
|
[ ] | |||||||||||||||
|
查看答案和解析>>
科目:高中化学 来源:2012届湖南省长沙一中高三上学期第一次月考化学试题 题型:单选题
将ag Fe2O3、Al2O3样品溶解在过量的200 mL 0.05 mol/L的硫酸溶液中然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
| A.0.1 mol·L-1 | B.0.2 mol·L-1 | C.0.4 mol·L-1 | D.0.8 mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com