
【题目】已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g)=COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min达到平衡,平衡时水的物质的量分数为2%,则下列说法不正确的是( )
A.CO2的平衡转化率α=2.5%
B.用H2S表示该反应的速率为0.001 mol·L-1·min-1
C.在620 K重复试验,平衡后水的物质的量分数为3%,说明该平衡正向移动了
D.反应过程中混合气体平均摩尔质量始终不变
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】向 2.0 L 浓度均为 1.0 mol·L1 的 CuSO4、Fe2(SO4)3 和 H2SO4 的混合液中加入足量的铁粉,反应停止后,铁粉有剩余,此时溶液中 Fe2+ 的物质的量浓度是(溶液的体积变化忽略不计)
A. 1.5 mol·L1 B. 2.0 mol·L1 C. 3.0 mol·L1 D. 5.0 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P结构简式为 ,其合成路线如下:
,其合成路线如下:

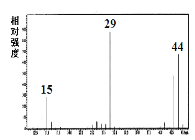
已知:①A是一种烃的含氧衍生物,它的质谱图如图。
②—CHO+
![]()

③醇容易被硝酸氧化。
(1)A的结构简式为___________。
(2)C中官能团的名称为______________。要检验C中的含氧官能团,下列可选用的试剂有________(填选项的序号)
A.新制的氢氧化铜 B.溴水 C.酸性高锰酸钾溶液 D.浓硫酸
(3)E→F的化学方程式为__________________。
(4)H的结构简式为__________。
(5)以甲苯为原料,选用必要的无机试剂合成H,写出合成路线_________。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同,浓度均为0.1 mol·L-1的:①(NH4)2CO3,②(NH4)2Fe(SO4)2,③氨水,④NH4NO3,⑤ NH4HSO4溶液,它们中的c(NH![]() )由大到小的排列顺序是( )
)由大到小的排列顺序是( )
A. ②⑤④①③ B. ③⑤②④①
C. ②①⑤④③ D. ⑤②①④③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,碳酸、醋酸和亚硫酸的电离平衡常数见下表:
名称 | 碳酸 | 醋酸 | 亚硫酸 |
电离常数(298K) | K1=4.4×10–7 K2=4.7×10–11 | K=1.8×10–5 | K1=1.3×10–2 K2=6.2×10–8 |
(1)298K时,碳酸、醋酸和亚硫酸,从强到弱的顺序_______________________.(用化学式表示)
(2)用离子方程式表示Na2SO3溶液显碱性的原因_______________________。
(3)25℃时,相同浓度的CH3COONa溶液的碱性________Na2CO3溶液的碱性(填“>”“<”或“=”)。
(4)向醋酸溶液中加少量NaOH溶液,醋酸的电离平衡常数________(填“增大”、“减小”、“不变”).
(5)已知常温下:某NaHSO3溶液的pH=5,则该NaHSO3溶液中c(H2SO3) ________ c(SO32-)(填“>”“<”或“=”).
(6)25℃时,PH=4的亚硫酸溶液与PH=10的NaOH溶液等体积混合后,溶液显_________性.
A.酸性 B.碱性 C.中性 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,将
时,将![]() 、
、![]() 分别充入两个各为
分别充入两个各为![]() 的密闭容器中,反应过程中浓度变化如下:
的密闭容器中,反应过程中浓度变化如下:![]() ,下列说法正确的是
,下列说法正确的是![]()
容器 | 物质 | 起始浓度 | 平衡浓度 |
Ⅰ |
|
|
|
| 0 |
| |
Ⅱ |
| 0 |
|
|
|
|
A.平衡时,Ⅰ、Ⅱ中反应物的转化率![]()
B.平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]()
C.平衡后,Ⅰ中加入![]() 的
的![]() ,达到新平衡时,反应物的转化率
,达到新平衡时,反应物的转化率![]() 增大
增大
D.平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的A、B密闭容器中分别充入2 mol SO2和1 mol O2,使它们在一定温度下反应,并达新平衡:2SO2+O2![]() 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
A. 25%B. 大于25%
C. 小于25%D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HI常用作有机反应中的还原剂,受热会发生分解反应。已知![]() 时:
时:![]() ,向1L密闭容器中充入1molHI,
,向1L密闭容器中充入1molHI,![]() 时,体系中
时,体系中![]() 与反应时间t的关系如图所示。下列说法中,正确的是
与反应时间t的关系如图所示。下列说法中,正确的是
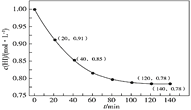
A.![]() min内的平均反应速率可表示为
min内的平均反应速率可表示为![]()
![]()
B.升高温度,再次平衡时,![]()
![]()
C.该反应的化学平衡常数计算式为![]()
D.反应进行40min时,体系吸收的热量约为![]() kJ
kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1) NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)NO2(g)+O2(g);ΔH1=-200.9 kJ·mol-1
SO2(g)+O3(g)SO3(g)+O2(g);ΔH2=-241.6 kJ·mol-1
2SO2(g)+O2(g)2SO3(g);ΔH3=-196.6 kJ·mol-1
则反应2NO2(g)2NO(g)+O2(g)的ΔH= ________kJ·mol-1。
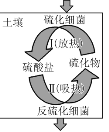
(2) 土壤中的硫循环如图所示,土壤中的黄铁矿(FeS2)在过程Ⅰ中会转化成硫酸亚铁和硫酸,该过程发生的化学方程式为________;某种反硫化细菌在过程Ⅱ中需要有乳酸参与反应消耗硫酸,生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,还存在另一作用并解释原因:________。
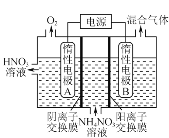
(3) 电解法除去工业废水中的硝酸铵的装置示意图如图所示,阴极电极反应式为_______。
(4) 向恒容密闭容器中充入1 mol NO和2 mol O3,发生如下反应:NO(g)+O3(g)NO2(g)+O2(g);ΔH<0。不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图。温度低于100 ℃时,NO转化率随温度升高而增大的主要原因是________;当温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:①________,②________。
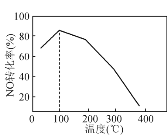
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com