
Ⅰ、(8分)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒醮取试样进行检测。
(1)该学生的操作是 (填“正确的”或“错误的”)。
(2)如不正确,是否一定有误差?答: (填“是”或“否”)
(3)若按此法分别测定C(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是 。
Ⅱ、(10分)
(1)如图表示50mL滴定管中液面的位置,其读数是 mL
(2)乙二酸俗名草酸,某化学学习小组的同学欲探究测定
|
科目:高中化学 来源: 题型:阅读理解
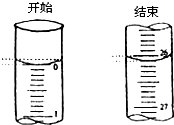 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一学生在实验室测某溶液的PH,实验时,他先用蒸馏水润湿PH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测.
(1)该生的操作方法是否正确?
(2)如不正确请说明理由,同时请分析是否一定有误差产生.
(3)若用此法分别测定c(H+)相等的H3PO4和H2SO4溶液的PH,结果会怎样?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)该生的操作方法是否正确?
(2)如不正确请说明理由,并分析是否一定有误差产生。
(3)若用此法分别测定c(H+)相等的H2SO4和H3PO4溶液的pH,结果会怎样?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 。
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)有一学生在实验室测某溶液的pH。实验时他先用蒸馏水湿润pH试纸,然后用洁净的玻璃棒蘸取试样进行检测。
①该学生的操作 (填“正确”或“不正确”),如不正确,请分析是否一定有误差并说明理由(若正确则此问不用作答)
。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是 。
查看答案和解析>>
科目:高中化学 来源:2013届陕西省西安市高二12月月考化学试卷(解析版) 题型:实验题
⑴有一学生在实验室测某溶液pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
①这种错误操作 (填“一定”/“一定不”/“不一定”)会导致实验结果有误差。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 。
⑵、用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考右图,从表中选出正确序号 _____________
|
序号 |
锥形瓶中溶液 |
滴定管中溶液 |
选用指示剂 |
|
|
A |
碱 |
酸 |
石芯 |
(乙) |
|
B |
酸 |
碱 |
酚酞 |
(甲) |
|
C |
碱 |
酸 |
甲基橙 |
(甲) |
|
D |
酸 |
碱 |
酚酞 |
(乙) |
⑶、用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
⑷、已知滴定管中装有浓度为0.112mol/L的盐酸。逐滴加入到装有氢氧化钠的溶液的锥形瓶中。开始时读数及恰好反应时盐酸的读数见下表。
|
实验 编号 |
待测氢氧化钠溶液体积(mL) |
滴定开始读数(mL) |
滴定结束读数(mL) |
消耗盐酸体积(mL) |
|
① |
25.00 |
0.02 |
26.40 |
|
|
② |
25.00 |
0.04 |
25.81 |
|
|
③ |
25.00 |
0.03 |
25.78 |
|
|
④ |
25.00 |
0.20 |
25.96 |
|
试计算待测的氢氧化钠的物质的量浓度= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com