
| A. | 45g水中含有的水分子数是2.5NA | |
| B. | 标准状况下,33.6LCO中含有的原子数是3NA | |
| C. | 0.5L、0.2mol/L的NaCl溶液中含有的Na+数是0.1NA | |
| D. | 1molCH4含电子数目为8NA |
分析 A.根据水的质量、摩尔质量计算出水的物质的量及分子数;
B.根据标况下气体体积及标况下的气体摩尔体积计算出一氧化碳的物质的量及含有的原子数;
C.根据n=cV计算出溶液中溶质氯化钠的物质的量,再计算出钠离子的物质的量;
D.甲烷含有10个电子,1mol甲烷含有10mol电子.
解答 解:A.45g水的物质的量为:$\frac{45g}{18g/mol}$=2.5mol,含有的水分子数是2.5NA,故A正确;
B.标况下,33.6L一氧化碳的物质的量为1.5mol,含有3mol原子,含有的原子数是3NA,故B正确;
C.0.5L 0.2mol/L的NaCl(aq)中含有溶质氯化钠0.1mol,0.1mol氯化钠中含有0.1mol钠离子,含有的Na+数是0.1NA,故C正确;
D.1molCH4中含有10mol电子,含电子数目为10NA,故D错误;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
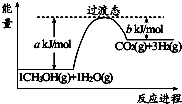
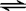 2NH3(g)△H=-92kJ•mol-1.
2NH3(g)△H=-92kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaOH | C. | Mg(OH)2 | D. | NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧某白色粉末,火焰呈黄色,证明原粉末中含有Na+,无K+ | |
| B. | 实验中要配制500mL0.2mol•L-1KCl溶液,需用托盘天平称量7.45gKCl固体 | |
| C. | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,证明NH4Cl固体易升华 | |
| D. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加沸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2H+=Ca2++CO2↑+H2O | B. | 2Fe2++Cl2=2Fe3++2Cl- | ||
| C. | HCO3-+H+=CO2↑+H2O | D. | H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
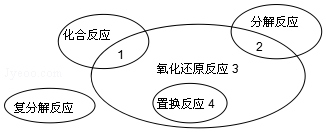
| A. | 2K2O2+2CO2═2K2CO3+O2 | B. | Cl2+2KBr═Br2+2KCl | ||
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | D. | 2NaHCO3═Na2CO3+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com