
 O2-中的质子数是______,中子数是______,核外电子数是______,质量数是______,画出此微粒的离子结构示意图:______
O2-中的质子数是______,中子数是______,核外电子数是______,质量数是______,画出此微粒的离子结构示意图:______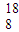 O2-中的质子数是8,质量数是18,;质子数+中子数=质量数,所以其中子数为10,阴离子的电子数=质子数+电荷数.所以其电子数为10,离子结构示意图为:
O2-中的质子数是8,质量数是18,;质子数+中子数=质量数,所以其中子数为10,阴离子的电子数=质子数+电荷数.所以其电子数为10,离子结构示意图为: ,故答案为:8;8;10;
,故答案为:8;8;10; ;
; ;
; ,
, ;
; .
.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 16 |
| 3 |
| 容器 | 容器1 | 容器2 | 容器3 |
| 反应物投入量(始态) | 1molCO2、3molH2 | 0.5molCO2、1.5molH2 | 1molCH3OH、1molH2O |
| CH3OH的平衡浓度/mol?L-1 | c1 | c2 | c3 |
| 平衡时体系压强/Pa | p1 | p2 | p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
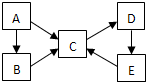 A、B、C、D、E五种物质(或离子)均含有同一种短周期元素,它们之间有如转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种短周期元素,它们之间有如转化关系:| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
 2PbSO4+2H2O:
2PbSO4+2H2O:
| ||
| 叶绿体 |
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:计算题
近年来,以天然气等为原料合成甲醇的难题被一一攻克,极大地促进了甲醇化学的发展。
(1)与炭和水蒸气的反应相似,以天然气为原料也可以制得CO和H2,该反应的化学方程式为_________。
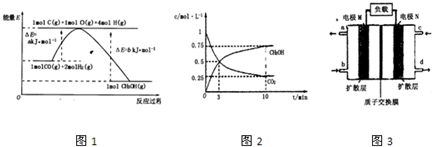
(2)合成甲醇的一种方法是以CO和H2为原料,其能量变化如图所示:
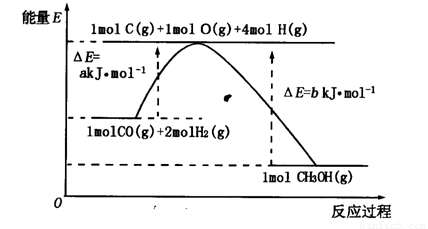
由图可知,合成甲醇的热化学方程式为________________________________________。
(3)以CO2为原料也可以合成甲醇,其反应原理为:CO2(g)+3H2(g)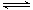 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在lL的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时问变化如图所示:
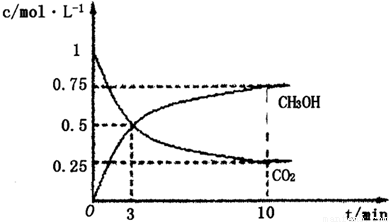
则下列说法正确的是_________________(填字母);
A.3min时反应达到平衡
B.0~10min时用H2表示的反应速率为0.225mol·-1·min-1
C.CO2的平衡转化率为25%
D.该温度时化学平衡常数为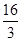 (mol/L)-2
(mol/L)-2
②在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
容器1 |
容器2 |
容器3 |
|
反应物投入量(始态) |
1molCO2、3molH2 |
0.5molCO2、1.5molH2 |
1molCH3OH、1molH2O |
|
CH3OH的平衡浓度/mol•L-1 |
c1 |
c2 |
c3 |
|
平衡时体系压强/Pa |
p1 |
p2 |
p3 |
则下列各量的大小关系为c1___________c3,p2_________p3(填“大于”、“等于”或“小于”)。
(4)近年来,甲醇燃料电池技术获得了新的突破,如图所示为甲醇燃料电池的装置示意图。电池工作时,分别从b、c充入CH3OH、O2,回答下列问题:
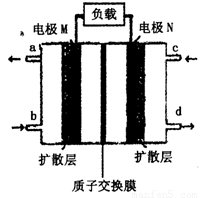
①从d处排出的物质是___________,溶液中的质子移向电极__________(填“M”或“N”);
②电极M上发生的电极反应式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com