
物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
A.4.6g
B.4.2g
C.4.0g
D.3.2g
科目:高中化学 来源: 题型:选择题
 )共聚而成,则单体A可能为( )
)共聚而成,则单体A可能为( )| A. | C2H5-CH═CH-CH3 | B. |  | C. |  | D. | CH3C═CH-CH2CH3 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
常温时,下列混合溶液的pH 一定小于7的是( )
A.pH = 3的盐酸和pH = ll的氨水等体积混合
B.pH = 3的盐酸和pH = 11的氢氧化钡溶液等体积混合
C.pH = 3的硫酸和pH = ll的氨水等体积混合
D.pH = 3的醋酸和pH = ll的氨氧化钡溶液等体积混合
查看答案和解析>>
科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:选择题
向铁铜合金中加入硝酸溶液恰好完全反应,得到NO2、N2O4、NO混合气体,向反应后溶液中加入2mol/LNaOH溶液,至沉淀恰好完全。若将得到的NO2、N2O4、NO混合气体,与2.24L(标准状况下)O2混合后通入水中恰好被完全吸收生成硝酸。则反应中消耗的NaOH溶液的体积是
A.150ml
B.180ml
C.200ml
D.250ml.
查看答案和解析>>
科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:选择题
下图表示铁与不同浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系,则下列说法不正确的是
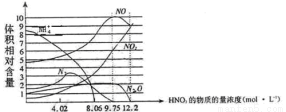
A.一般来说,硝酸与铁反应的还原产物不是单一的
B.用一定量的铁粉与大量的9.75mol·L—1HNO3溶液反应得到标态下气体2.24L,则参加反应的硝酸的物质的量为0.1mol.
C.硝酸的浓度越大,其还原产物中价态越高的成份越多
D.当硝酸浓度为9.75mol·L—1时还原产物是NO、NO2、N2O,且其物质的量之比为5:3:1
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:计算题
综合题:
氢气是清洁的能源,也是重要的化工原料,根据以下三种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g) 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见下图,图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
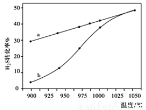
①△H0,(“>”、“<”或“=”)。
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=
(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)△H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=kJ/mol;
CaCO3(s)+2H2(g)的△H=kJ/mol;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是。(填字母)
A.降低体系的温度
B.压缩容器的体积
C.增加CaO的量
D.选用适当的催化剂
(3)方法三:利用甲醇可以与水蒸气反 应制取H2,反应方程式如下:
应制取H2,反应方程式如下:
CH3OH(g)+H2O(g) CO2(g)+3H2(g)△H=+49.4kJ/mol
CO2(g)+3H2(g)△H=+49.4kJ/mol
一定温度下,向容积为2L的密闭恒容容器中充入1molCH3OH(g)和3molH2O(g),达到平衡状态时,吸收热量19.76kJ。则
①达平衡时混合气体的压强是反应前的倍。
②此温度下的该反应的平衡常数是(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1mol正盐的△H=-24.2kJ•mol-1,强酸、强碱稀溶液反应的中和热为△H=-57.3kJ•mol-1,则NH3·H2O在水溶液中电离的△H等于
A.-69.4kJ/mol
B.-45.2kJ/mol
C.+69.4kJ/mol
D.+45.2kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:简答题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H=bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H=ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=_________kJ·mol-1
(2)工业上极少用方法I制取Cu2O是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:________________。
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为_________________________。
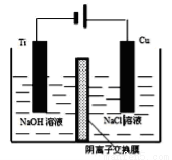
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:写出电极反应式并说明该装置制备Cu2O的原理___________________。
(5)在相同的密闭容器中.用以上两种方法制得的Cu2O分别进行催化分解水的实验:
 △H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:
△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:

下列叙述正确的是_________(填字母)。
A.实验的温度:T2<T1
B.实验①前20min的平均反应速率v(O2)=7×10-5mol·L-1·min-1
C.实验②比实验①所用的Cu2O催化效率高
D.实脸①、②、③的化学平衡常数的关系:K1=K2<K3
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 等浓度等体积的Na2CO3溶液与NaClO溶液混合后:2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| C. | 室温下,KOH与苯酚混合pH=7的溶液中:c(K+)>c(C6H5O-)>c(H+)=c(OH-) | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=10:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com