
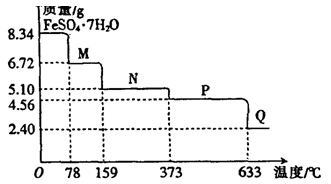
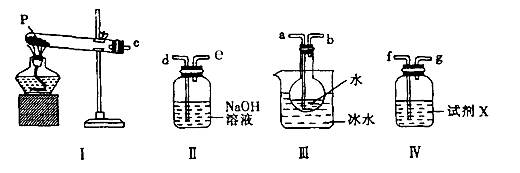

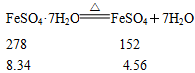
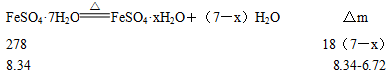
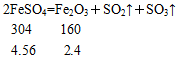
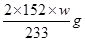


科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 实现现象 | 反应的离子方程式 |
| 往滤渣中加入过量NaOH溶液。 | | ① |
| 过滤,往所得滤液中通入过量二氧化碳, | ② | ③ |
| 继续加入过量稀盐酸 | ④ | |
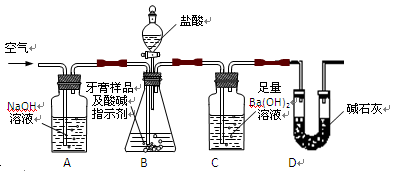
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏低 |
| B.向FeSO4溶液中滴入NaOH溶液,可立即观察到红褐色沉淀 |
| C.可用湿润的淀粉KI试纸检验HCl气体中是否含有Cl2 |
| D.SO2能使滴有酚酞的NaOH溶液褪色,说明SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将坩埚直接放在三角架上进行加热 |
| B.坩埚在加热前未完全干燥,可使测定的结果偏低 |
| C.加热温度过高,使一部分硫酸铜分解,可使测定结果偏高 |
| D.实验步骤的顺序为:称量、研磨、加热、冷却、称量、再加热、冷却、称量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
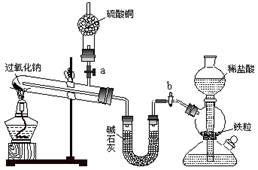
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
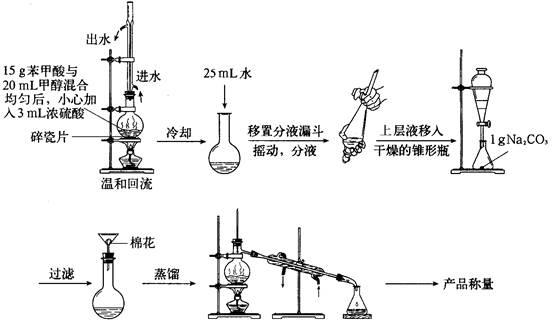

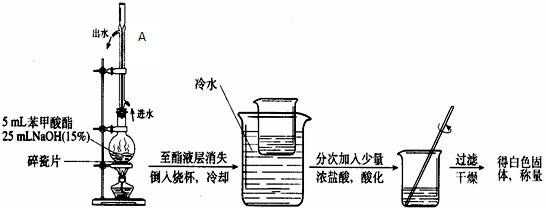
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 CO3?10H2O和NaH
CO3?10H2O和NaH CO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。
CO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。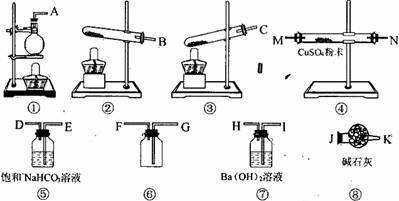
 的装置连接好后,最后一个装置的作用是_______________________________。
的装置连接好后,最后一个装置的作用是_______________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com