
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题: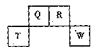
 (1)T的原子结构示意图为_______.
(1)T的原子结构示意图为_______. (2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。 (3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____. (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________. (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________. (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的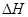 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质) (1)
(1)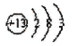
 (3)S + 2H2SO4(浓)
(3)S + 2H2SO4(浓) 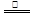 3SO2↑+ 2H2O
3SO2↑+ 2H2O (4)2H2O2 MnO22H2O + O2↑(或其他合理答案)
(4)2H2O2 MnO22H2O + O2↑(或其他合理答案) (5)NaNO2
(5)NaNO2  (6)(3a – 4b)KJ/mol
(6)(3a – 4b)KJ/mol
 CO2 ?△H= -a KJ/mol①,4Al +3 O2 =2Al2O3 △H= -4bKJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al + 3CO2
CO2 ?△H= -a KJ/mol①,4Al +3 O2 =2Al2O3 △H= -4bKJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al + 3CO2 3C + 2Al2O3,此反应的?H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)KJ/mol.
3C + 2Al2O3,此反应的?H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)KJ/mol.

科目:高中化学 来源:不详 题型:填空题







查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠在空气中易变质,最后变为过氧化钠 |
| B.钠在空气中燃烧生成Na2O |
| C.钠切开后,横断面变暗属于化学变化;焰色反应属于物理变化 |
| D.钠的还原性很强,与硫酸铜溶液反应会置换出红色的铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com