
| A. | 0.75mol硫酸 | B. | 0.75盐酸 | C. | 0.5mol硝酸 | D. | 0.75mol醋酸 |
分析 中和反应是酸与碱作用生成盐和水的反应,根据方程式定比关系计算消耗酸的物质的量结合各选项进行判断.
解答 解:中和反应是酸与碱作用生成盐和水的反应,
A.H2SO4+2NaOH═Na2SO4+2H2O,完全中和1.5molNaOH需0.75mol硫酸,故A正确;
B.HCl+NaOH═NaCl+H2O,完全中和1.5molNaOH需1.5molHCl,故B错误;
C.HNO3+NaOH═NaNO3+H2O,完全中和1.5molNaOH需1.5molHNO3,故C错误;
D.CH3COOH+NaOH═CH3COONa+H2O,完全中和1.5molNaOH需1.5molCH3COOH,故D错误;
故选A.
点评 本题难度不大,掌握中和反应的特征(反应物是酸和碱,生成物是盐和水)实质是正确解答此类题的关键.


科目:高中化学 来源: 题型:解答题
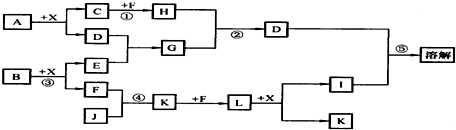
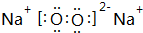 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:多选题
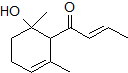 ,可用于制作香水.有关该化合物的下列说法正确的是( )
,可用于制作香水.有关该化合物的下列说法正确的是( )| A. | 分子式为C12H20O2 | B. | 该化合物可使酸性KMnO4溶液褪色 | ||
| C. | 该化合物可与NaOH溶液发生反应 | D. | 1 mol该化合物可与2 mol Br2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中的溶质是NH4Cl和NH3•H2O,则不等式c(NH4+)>c(Cl-)>c(NH3•H2O)>c(H+)一定正确 | |
| C. | 若溶液中四种离子满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl | |
| D. | 若溶液中c(Cl-)=c(NH4+),则该溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水洗净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 用酚酞作指示剂时,滴至溶液从红色变成无色即视为滴定终点 | |
| D. | 用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Mg2+ | C. | Al3+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②④ | C. | ①②③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com