
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素。其中X是形成化合物种类最多的元素,Y原子基态时2p原子轨道上有3个未成对的电子,Z单质占空气体积的![]() ,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的电负性从大到小的顺序是___ (用元素符号表示,下同),三种元素的第一电离能由大到小的顺序为______。
(2)写出X的电子排布式_____。
(3)W同周期的元素中,与W原子最外层电子数相等的元素还有_____。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是____(用化学式表示),原因是_________。
【答案】O>N>C N>O>C 1s22s22p2 K、Cr CH4 > NH3 > H2O 价层电子对数相同,孤电子对数越多,斥力越大,键角越小
【解析】
X、Y、Z、W是原子序数依次增大的前四周期元素。其中X是形成化合物种类最多的元素,则X为C元素,Y原子基态时2p原子轨道上有3个未成对的电子,则Y原子基态时核外电子排布式为1s22s22p3,则Y为N元素,Z单质占空气体积的![]() ,则Z为O元素,W的内层电子全充满,最外层只有1个电子,处于第四周期,核外电子数为2+8+18+1=29,故W为Cu元素,据此答题。
,则Z为O元素,W的内层电子全充满,最外层只有1个电子,处于第四周期,核外电子数为2+8+18+1=29,故W为Cu元素,据此答题。
由分析可知:X为C元素,Y为N元素,Z为O元素,W为Cu元素。
(1)由分析可知:X为C元素、Y为N元素、Z为O元素,元素的非金属性越强,则电负性越大,C、N、O为同一周期元素,元素的非金属性逐渐增强,所以电负性从大到小的顺序是O>N>C;同一周期的元素随着原子序数的增大,第一电离能呈逐渐增大的趋势,但N元素的2p能级为半充满的稳定状态,能量较低,第一电离能高于同周期的相邻元素,故第一电离能由大到小的顺序为N>O>C,故答案为:O>N>C,N>O>C。
(2)X为C元素,C元素的原子序数为6,其电子排布式为:1s22s22p2,故答案为:1s22s22p2。
(3)W为Cu元素,价电子排布式为3d104s1,与Cu原子最外层电子数相等的元素还有3d64s1,为K元素,3d54s1为Cr元素,故答案为:K、Cr。
(4)X、Y、Z的简单氢化物分别为CH4、NH3、H2O,3种氢化物的中心原子价层电子对数均为4,价层电子对数相同,孤电子对数越多,斥力越大,导致键角变小,故键角从大到小的顺序是CH4>NH3>H2O,故答案为:CH4>NH3>H2O;价层电子对数相同,孤电子对数越多,斥力越大,键角越小。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大,Z的最高化合价与最低化合价的代数和为零.下列说法正确的是
A.单质的氧化性:X>M
B.气态氢化物的热稳定性:M>N
C.X与Y简单离子半径:r(X离子)<r(Y离子)
D.化合物ZX2与ZN4含有相同类型的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A.该反应可用MnO2、FeCl3溶液作为催化剂
B.0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C.0~10 min,过氧化氢的分解速率逐渐加快
D.反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 晶体中与每个K+距离最近的O2-有6个
C. 晶体中,所有原子之间都以离子键相结合
D. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。

(1)在①~⑩元素的电负性最大的是:_____(填化学式)。
(2)⑨元素有____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布式为:_________。
(4)⑤的氢化物与⑦的氢化物比较稳定的是:___,沸点较高的是:____(填化学式)。
(5)元素⑦和⑧形成的化合物属于____晶体,它比Na2O的熔点____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是物质A的一种制备方法以及由A引发的系列反应。
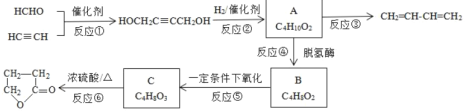
完成下列填空:
(1)HCHO中官能团的名称___。
(2)写出实验室制备CH![]() CH的化学方程式:__。
CH的化学方程式:__。
(3)写出反应类型。反应①:___反应,反应③:___反应。
(4)化合物B含酯基的同分异构体共4种,写出其余3种的结构简式:___。
(5)如何检验B是否完全转化为C?__。
(6)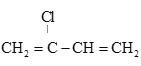 是制备氯丁橡胶的原料,以下是一种以CH2=CH-CH=CH2为原料制备
是制备氯丁橡胶的原料,以下是一种以CH2=CH-CH=CH2为原料制备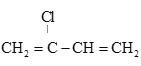 的合成路线的一部分,请补全其余3步:CH2=CH-CH=CH2
的合成路线的一部分,请补全其余3步:CH2=CH-CH=CH2 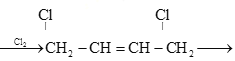 ________,(合成路线常用的表示方式为:甲
________,(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为____,原子个数比为_____,分子的物质的量之比为____。
(2)等温等压下,等体积的O2和O3所含分子个数比为___,原子个数比为_____,质量比为___。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__(用含NA的式子表示)。
(4)配制100 mL 1 mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为____ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铁屑(主要成分为Fe,还含有C,S,P等)制取高效净水剂K2FeO4流程如图:
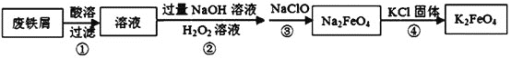
下列说法不正确的是
A. 废铁屑在酸溶前可用热的纯碱溶液去油污
B. 步骤②是将Fe2+转化为Fe(OH)3
C. 步骤③中发生的反应的离子方程式为2Fe(OH)3+3ClO-==2FeO42-+3Cl-+4H++H2O
D. 步骤④中反应能发生的原因是在相同条件下,K2FeO4的溶解度小于Na2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )

A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为b
D. 淡化过程中易在戊室形成水垢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com