
| A. | SiO2与所有的酸都不能发生反应 | |
| B. | 将CO2、SO2通入Ca(ClO)2溶液均发生反应且反应类型相同 | |
| C. | 过量的铜与浓硝酸反应能生成NO气体 | |
| D. | 加盐酸产生能使澄清石灰水变浑浊气体的钠盐为Na2CO3 |
分析 A.二氧化硅能与氢氟酸反应;
B.将CO2与Ca(ClO)2溶液中发生复分解反应,而SO2通入Ca(ClO)2溶液发生氧化还原反应;
C.铜与浓硝酸反应,还原产物为二氧化氮,与稀硝酸反应还原产物为一氧化氮;
D.依据碳酸盐、碳酸氢盐、亚硫酸氢盐、亚硫酸盐与盐酸反应生成二氧化碳、二氧化硫,两种气体都能使澄清石灰水变浑浊;
解答 解:A.二氧化硅能与氢氟酸反应生成四氟化硅气体,故A错误;
B.将CO2与Ca(ClO)2溶液中发生复分解反应,而SO2通入Ca(ClO)2溶液发生氧化还原反应,则反应的类型不同,故B错误;
C.铜与浓硝酸反应,还原产物为二氧化氮,铜过量,随着反应进行,硝酸浓度降低,变为稀硝酸,与铜反应生成一氧化氮,故C正确;
D.加盐酸产生能使澄清石灰水变浑浊气体的钠盐可能为Na2CO3或者碳酸氢钠,亚硫酸氢钠、亚硫酸钠,故D错误;
故选:C.
点评 本题考查了元素化合物知识,明确二氧化碳、二氧化硫、浓硝酸的性质是解题关键,注意铜与硝酸反应产物与浓度的关系,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
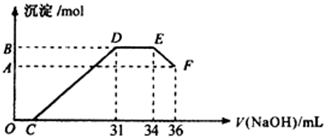
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Fe(NO3)2 溶液中滴加少量稀盐酸:Fe2++NO3-+4H+═Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
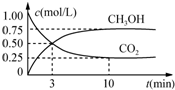 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3 min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向上述容器中充入0.5 mol CO2、1.5 mol H2,平衡时CO2的转化率小于75% | |
| D. | 12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
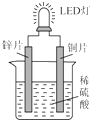 如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )
如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )| A. | 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生 | |
| B. | 如果将锌片换成铁片,电路中的电流方向将改变 | |
| C. | 其能量转化的形式主要是“化学能→电能→光能” | |
| D. | 如果将稀硫酸换成柠檬汁,LED灯将不会发光 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A |  | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 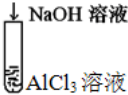 | 溶液由先浑浊后澄清 | Al3++3OH-═Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O |
| C | 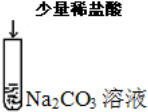 | 溶液中无气泡产生 | CO22-+H+=HCO3-+H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com