
【题目】按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__。
(2)常温下,向一定体积的0.1mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是__(填字母)。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)也增大
C.溶液中![]() 不变
不变
D.溶液中![]() 减小
减小
(3)①常温下将0.15mol·L-1的稀硫酸V1mL与0.1mol·L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1∶V2=__(溶液体积的变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是__(填字母)。
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol·L-1的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是__(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是__(填字母)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如表所示:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,__(填离子符号)先沉淀。
【答案】c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH-)>c(H+) C、D 1∶1 A、D A A、B Cu2+
)>c(OH-)>c(H+) C、D 1∶1 A、D A A、B Cu2+
【解析】
(1)用100mL3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,生成等浓度的碳酸钠、碳酸氢钠混合液;
(2)常温下,向一定体积的0.1mol·L-1的醋酸溶液中加水稀释,醋酸电离平衡正向移动,电离平衡常数不变;
(3)酸碱混合后,溶液呈酸性,说明硫酸过量,根据![]() 计算;
计算;
(4)弱酸的酸性越弱,酸根离子水解程度越大,由表格数据可知,酸性CH3COOH>H2CO3 >HClO>HCN>HCO3-;
(5)根据表格数据分析;
(1)用100mL3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,生成等浓度的碳酸钠、碳酸氢钠混合液,碳酸钠、碳酸氢钠水解呈碱性,碳酸钠水解程度大于碳酸氢钠水解,所以溶液中离子浓度大小关系是c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH-)>c(H+);
)>c(OH-)>c(H+);
(2) A.醋酸溶液中加水稀释,醋酸电离平衡正向移动,溶液中导电粒子的数目增多,故A错误;
B.醋酸溶液中加水稀释,醋酸电离平衡正向移动,醋酸的电离程度增大,但c(H+)减小,故B错误;
C.醋酸溶液中加水稀释,电离平衡常数不变,![]() ,故C正确;
,故C正确;
D.无限稀释相当于水,但体积增加,醋酸根离子浓度减小,氢离子浓度基本不变,所以![]() 减小,故D正确;选CD;
减小,故D正确;选CD;
(3) ① ![]() ,
,![]() ,V1∶V2=1∶1;
,V1∶V2=1∶1;
②A.若混合后溶液呈中性,c(H+)=c(OH-)=1×10-7mol·L-1,所以c(H+)+c(OH-)=2×10-7mol·L-1,故A正确;
B.若HA是弱酸,V1=V2,混合后HA剩余,溶液的pH小于7,故B错误;
C. 若HA是弱酸,V1=V2,混合后HA剩余,混合后溶液呈酸性,故C错误;
D.若HA是强酸,混合后溶液呈碱性,说明碱过量,则V1小于V2;若HA是弱酸,V1=V2,混合后HA剩余,混合后溶液呈酸性,若混合后溶液呈碱性,则V1小于V2,故D正确;选AD;
(4)①由表格数据可知,酸性CH3COOH>H2CO3 >HClO>HCN;酸性越弱,稀释相同倍数pH变化越小,将浓度均为0.01mol·L-1四种酸的溶液分别稀释100倍,pH变化最小的是.HCN ,选A;
②A.酸性CH3COOH>H2CO3 ,根据强酸制弱酸,CH3COOH+Na2CO3=NaHCO3+CH3COONa能发生;
B.酸性CH3COOH>HCN,根据强酸制弱酸,CH3COOH+NaCN=CH3COONa+HCN能发生;
C.H2CO3 >HClO>HCO3-,根据强酸制弱酸,-CO2+H2O+2NaClO=Na2CO3+2HClO不能发生;
D.酸性H2CO3 >HCN ,根据强酸制弱酸,NaHCO3+HCN=NaCN+H2O+CO2↑不能发生;故选AB;
(5) 根据表格数据,
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,Cu2+先沉淀,Mg2+最后沉淀。


科目:高中化学 来源: 题型:
【题目】实验测得常温下0.1mol/L某一元酸HA溶液的pH值大于1,0.1mol/L某一元碱BOH溶液里![]() =10-12。将此两种溶液等体积混合后,所得溶液的各离子的浓度由大到小排列的顺序( )
=10-12。将此两种溶液等体积混合后,所得溶液的各离子的浓度由大到小排列的顺序( )
A.c(B+)>c(A-)>c(OH-)>c(H+)B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-)D.c(B+)>c(A-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活、生产、环境、资源利用等息息相关。回答下列问题:
(1)氯化铁可用于净水,写出其溶于水的电离方程式:________;在氯化铁溶液中加入铁粉,发生反应的离子方程式是___________;在氯化铁的水溶液中逐滴加入氢氧化钠溶液,可观察到的现象是__________。
(2)漂白粉常用作棉、麻、纸张的漂白剂,还可用作游泳池及环境消毒剂。漂白粉的有效成分为_________,写出漂白粉在空气中失效的有关化学方程式:_________、________。
(3)pH小于5.6的天然降水称为酸雨,引起酸雨的主要物质是SO2和_________。燃煤脱硫可有效减少酸雨的形成,燃煤脱硫除用石灰法外,也可以向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为MgSO4,写出该反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。则下列说法正确的是( )

A. X与A反应的化学方程式是:Al2O3 + 2Fe ![]() Fe2O3 + 2Al
Fe2O3 + 2Al
B. 检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C. 单质Y在一定条件下能与水发生置换反应
D. 由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )

实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 。下列说法正确的是
。下列说法正确的是
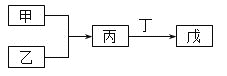
A.若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能具有漂白性
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲![]() 丙
丙![]() 戊
戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为__。
(2)B为0.1mol·L-1NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:__。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入__以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为_。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100mL蒸馏水中;②100mL0.2mol·L-1AgNO3溶液中;③100mL0.1mol·L-1氯化铝溶液中;④100mL0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是__(填序号);向②中加入足量氯化银后,氯离子的浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:
①KCl ②CH4 ③NH4NO3 ④I2 ⑤Na2O2 ⑥HClO4 ⑦N2 ⑧CO ⑨SO2 ⑩金刚石 CH3CH2OH MgO MgCl2 KOH HCl Al2O3
请回答下列问题。
(1)两性氧化物是___(填序号),其电子式为___。
(2)最简单的有机化合物是___(填序号),用电子式表示其形成过程:___。
(3)属于共价化合物的是___(填序号),含有共价键的离子化合物是___(填序号)。
(4)由两种元素组成,且含有离子键和共价键的化合物为___(填序号),这两种元素的单质反应生成该化合物的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2CH3OH(g)![]() C2H4(g)+2H2O(g)。 某研究小组将甲醇蒸气以一定的流速持续通过相同量的同种催化剂, 不同温度得到如下图像, 则下列结论不正确的是
C2H4(g)+2H2O(g)。 某研究小组将甲醇蒸气以一定的流速持续通过相同量的同种催化剂, 不同温度得到如下图像, 则下列结论不正确的是

A. 一段时间后甲醇反应率下降可能是催化剂活性下降
B. 综合图 1、 图 2 可知, 甲醇还发生了其他反应
C. 若改变甲醇蒸气的流速, 不会影响甲醇反应率和乙烯产率
D. 制乙烯比较适宜的温度是 450℃左右
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com