
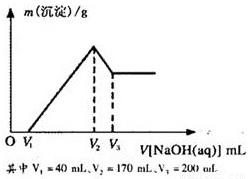
镁铝合金是烟花生产过程中的重要原料,同时也可作为白光剂和照明剂。为了探究镁铝合金中各成分的含量,康康同学将一定质量的镁铝合金投入到850 mL 一定物质的量浓度的稀硫酸中,合金全部溶解,然后又滴加5 mol·L-1的NaOH溶液。若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积(V)的变化如右图所示:
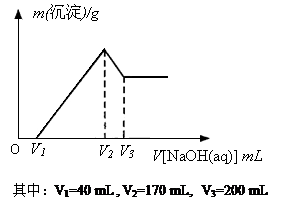
(1)请写出加入NaOH溶液的体积由V2→V3时,所发生的化学反应方程式:___________________ _ _______,并由此计算合金中铝的质量。
(2)计算合金中镁的质量。
(3)合金在溶于稀硫酸时,释放出的气体体积(标准状况)是多少?
(4)康康同学所用稀硫酸的物质的量浓度是多少?
(1) Al(OH)3 + NaOH == Na[Al(OH)4],0.15 mol
(2) 2.4 g (3) 7.28 L (4) 0.5 mol/L
(1)Al(OH)3 + NaOH == Na[Al(OH)4](2分),0.15 mol(1分)。
(2)2.4 g (过程1分,结果1分,共2分)
方法1:由Al的物质的量计算:在V1→V2时,Al3+消耗NaOH溶液的体积;进而得出Mg2+消耗NaOH溶液的体积,从而计算Mg的质量。
方法2:Al3+沉淀再溶解时消耗NaOH溶液的体积关系(3∶1),可直接得到Mg2+消耗NaOH溶液的体积为: (V2-V1)-3(V3-V2),从而计算Mg的质量。
(3)7.28 L (过程1分,结果1分,共2分)
方法1:由的物质的量分别计算放出H2体积,加和即可。
方法2:消耗NaOH溶液的体积为V2时,溶液的溶质为Na2SO4,从而可求出消耗H2SO4的总量;总H2SO4量减去“被NaOH中和的硫酸”(可从V1求得),就是与Mg、Al反应放H2的硫酸,由H元素守恒可得氢气体积。
方法3:V1→V2消耗NaOH的物质的量,就是Mg(OH)2、Al(OH)3中OH-的总量,也即Mg、Al失电子总量,其1/2就是H2的物质的。
(4)0.5 mol/L(过程1分,结果1分,共2分)
方法1:硫酸总的物质的量=被NaOH中和的硫酸+与Mg、Al反应的硫酸,从而求解。
方法2:消耗NaOH溶液的体积为V2时,溶液的溶质全为Na2SO4,从而可求出消耗H2SO4的总量,进而求解。


科目:高中化学 来源: 题型:
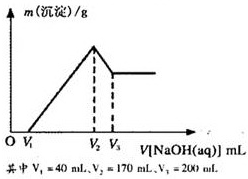 镁铝合金是烟花生产过程中的重要原料,同时也可作为白光剂和照明剂.为了探究镁铝合金中各成分的含量,康康同学将一定质量的镁铝合金投入到850mL、一定物质的量浓度的稀硫酸中,合金全部溶解,然后又滴加5mol/L的NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积(V)的变化如图所示.
镁铝合金是烟花生产过程中的重要原料,同时也可作为白光剂和照明剂.为了探究镁铝合金中各成分的含量,康康同学将一定质量的镁铝合金投入到850mL、一定物质的量浓度的稀硫酸中,合金全部溶解,然后又滴加5mol/L的NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积(V)的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构、性质等信息 |
| X | 构成有机物的主角,该元素的一种氧化物和气态氢化物都是典型的温室气体. |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质. |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性. |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂. |
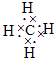
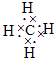
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
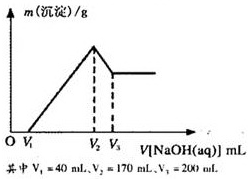 镁铝合金是烟花生产过程中的重要原料,同时也可作为白光剂和照明剂.为了探究镁铝合金中各成分的含量,康康同学将一定质量的镁铝合金投入到850mL、一定物质的量浓度的稀硫酸中,合金全部溶解,然后又滴加5mol/L的NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积(V)的变化如图所示.
镁铝合金是烟花生产过程中的重要原料,同时也可作为白光剂和照明剂.为了探究镁铝合金中各成分的含量,康康同学将一定质量的镁铝合金投入到850mL、一定物质的量浓度的稀硫酸中,合金全部溶解,然后又滴加5mol/L的NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积(V)的变化如图所示.查看答案和解析>>
科目:高中化学 来源:2009-2010学年河南省郑州市高一(上)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com