
【题目】一种三层(熔)液电解辉锑矿(Sb2S3,半导体)制取锑的装置如图所示。 下列说法错误的是( )
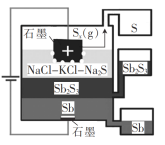
A.Sb在阴极生成
B.三层流体互不相溶,密度也不同
C.阳极的电极反应式为xS2- - 2xe- = Sx
D.该电解工艺可在室温下工作
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如图,其总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是
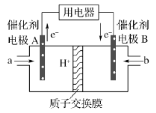
A. 电极A是负极,发生氧化反应
B. 电池工作时,电解液中的H+通过质子交换膜向B电极迁移
C. 放电前后电解质溶液的pH不变
D. b物质在电极上发生的电极反应式为:O2+4e-+4H+=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,氦气在Pt催化剂作用下发生主反应Ⅰ和副反应Ⅱ:
Ⅰ.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1=-905 kJ/mol
4NO(g)+6H2O(g) △H1=-905 kJ/mol
Ⅱ.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2
2N2(g)+6H2O(g) △H2
(1)已知:
物质中断裂1mol化学键需要的能量/kJ | NO | O2 | N2 |
629 | 496 | 942 |
则△H2=___________。
(2)以Pt为催化剂,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量与温度的关系如下图:

①该催化剂在高温时对反应__________更有利(填“Ⅰ”或“Ⅱ”)。
②520℃时,NH3的转化率为____________。
③520℃时,反应Ⅱ的平衡常数K=________(数字计算式)。
④下列说法正确的是____________(填标号)。
A 工业上氨催化氧化生成NO时,最佳温度应控制在840℃左右
B 增大NH3和O2的初始投料比可以提高NH3生成NO的平衡转化率
C 投料比不变,增加反应物的浓度可以提高NH3生成NO的平衡转化率
D 使用催化剂时,可降低反应的活化能,加快其反应速率
⑤温度高于840℃时,NO的物质的量减少的原因可能是____________。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1mol N2时,转移的电子数为___________mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂的反应器中反应。
反应相同时间NOx的去除率随反应温度的变化曲线如下图所示,在50-250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由氢气、氮气合成氨气,溶于水形成氨水。一定温度下,向2L固定体积的密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。

(1)0~2min内的平均反应速率v(H2)=___。
(2)该温度下,反应的平衡常数表达式K=___。
其平衡常数K与温度T的关系如下表:
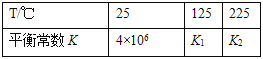
试判断K1___K2(填写“>”、“=”或“<”)。
(3)能说明该合成氨反应已达到平衡状态的是___(选填编号)。
a.3v(N2)=v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2mol·L-1,c(H2)=c(N2)=0.01mol·L-1
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。
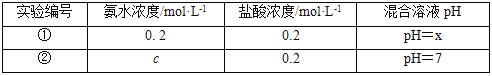
请回答:
(4)①中所得混合溶液,pH___7(填“>”、“<”或“=”);②中c__0.2(填“>”、“<”或“=”),所得混合溶液中各离子浓度大小关系为___。
(5)请你设计一个能证明一水合氨是弱电解质的简要方案___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)工业上常用苏打烧结法提取自然界中的稀散元素硒(Se),我国科研人员自主设计的利用粗铜电解精炼所产生含硒化亚铜(Cu2Se)和碲化亚铜(Cu2Te)的阳极泥为原料,提取硒的某种工艺流程如图所示。

回答下列问题:
(1)电解精炼铜时,电源的正极连接_______(填“粗铜”或“精铜”),阳极溶解铜的质量__________(填“>”“=”或“<”)阴极析出铜的质量。
(2)“烧结”时苏打和硒化亚铜主要生成了Na2SeO3、Cu2O和CO2气体,该反应的化学方程式为________________________________。“烧结”时生成了少部分Na2SeO4,写出“还原”时反应的离子方程式____________。
(3)含硒烧结物浸取时,最佳加热方式为________________,除去的物质为___________(填化学式)。
(4)本工艺副产物TeO2用于制造红外器件、声光器件材料,可溶于强酸和强碱,并形成复盐,则TeO2属于______氧化物(填“酸性”“碱性”或“两性”)。
(5)把硫酸工业第一步的产物SO2通入Na2SeO3溶液制备硒单质,写出该反应的离子方程式___________________。若得到50 kg硒单质,至少需要___________kg质量分数为90%的FeS2矿石。(结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础。如图为实验室制取蒸馏水的实验装置。
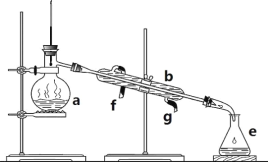
(1)写出下列仪器的名称:b.__;e___;
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是___,将仪器补充完整后进行实验,温度计水银球的位置在___处。冷凝水由__(填f或g)口通入,另一口流出。仪器a___(填能或不能)直接加热。
(3)实验时a中除加入少量自来水外,还需加入少量__,其作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp(CuS)=6.0×10-36,Ksp(ZnS)=3.0×10-25,Ksp(PbS)=9.0×10-29。在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇CuSO4溶液能转化成铜蓝(CuS)。下列有关说法不正确的是( )
A. ZnS转化成铜蓝的离子方程式为ZnS(s)+Cu2+(aq) ![]() Zn2+(aq)+CuS(s)
Zn2+(aq)+CuS(s)
B. 在水中的溶解度:S(ZnS)>S(PbS)>S(CuS)
C. 若溶液中c(Cu2+)=1×10-10 mol·L-1,则S2-已完全转化成CuS
D. 在白色ZnS浊液中滴加Pb(NO3)2溶液,不会生成黑色沉淀(PbS)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2A(g)B(g)。分别取1molA于2L的固定体积的容器中,分别在T1和T2下,测得A的转化率随时间变化的关系曲线如图所示。下列说法正确的是
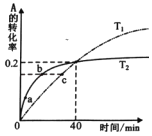
A.升高温度可缩短反应到达平衡的时间同时能提高A平衡的转化率
B.从反应开始至40min时,T2温度下生成B的物质的量比T1温度下多
C.图中a、b、c三点的化学反应速率依次减小
D.用B表示T1温度下前40min的平均反应速率:v(B)=0.0025molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥表示下列反应的电子转移方向和数目:
①Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O__________
②3Cl2+6KOH===5KCl+KClO3+3H2O_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com