
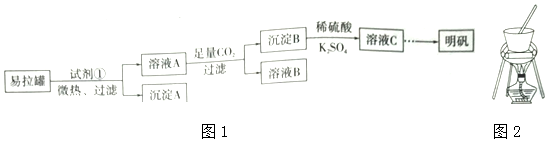
分析 易拉罐的主要成分为Al,含有少量的Fe、Mg杂质,可选择浓NaOH溶解,得到偏铝酸钠溶液(溶液A),并通过过滤除去Fe、Mg(沉淀A)等杂质,滤液中通入CO2溶液后,后生成氢氧化铝沉淀和碳酸氢钠,通过过滤得到碳酸氢钠溶液(溶B)和氢氧化铝(沉淀B),过滤后将沉淀溶解在稀硫酸中,得到硫酸铝溶液,添加K2SO4溶液后蒸发浓缩并冷却结晶得到晶体明矾,据此分析解答.
解答 解:(1)根据铝能溶解在强酸和强碱性溶液,而铁和镁只能溶解在强酸性溶液中的性质差异,可选择NaOH溶液溶解易拉罐,可除去含有的铁、镁等杂质;
故答案为:d;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)根据分析可知,偏铝酸钠溶液中通入CO2溶液后,后生成氢氧化铝沉淀和碳酸氢钠,通过过滤得到碳酸氢钠溶液(溶B)和氢氧化铝(沉淀B),溶液B为NaHCO3溶液;
故答案为:NaHCO3;
(4)硫酸铝溶液中添加K2SO4溶液后蒸发浓缩并冷却结晶、过滤、洗涤、干燥得到晶体明矾;蒸发不能使用坩埚;
故答案为:冷却结晶;蒸发不能使用坩埚;
(2)根据铝元素守恒,Al′~KAl(SO4)2•12H2O,理论上可得到明矾的质量为:$\frac{10g×90%×474}{27}$=158g,则明矾的回收率为$\frac{118.5}{158}×100%$=75%;
故答案为:75%.
点评 本题考查了制备方案的设计,题目难度中等,根据制备流程明确实验原理为解答关键,注意熟练掌握常见元素及其化合物性质,明确常见化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
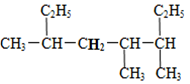
| A. | 4,5-二甲基-2-乙基庚烷 | B. | 3,4-二甲基-6-乙基庚烷 | ||
| C. | 4-甲基-2,5-二乙基己烷 | D. | 3,4,6-三甲基辛烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
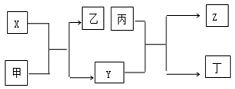 由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )
由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )| A. | X为第三周期II族元素,Y和Z位于同一主族 | |
| B. | 甲、乙、丙均能与水发生化合反应 | |
| C. | 工业上常用电解乙制备X | |
| D. | X可用于制焰火烟花,Z可用作太阳能电池的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
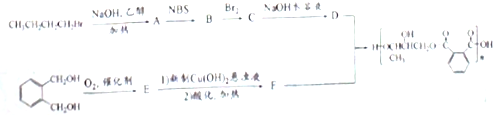

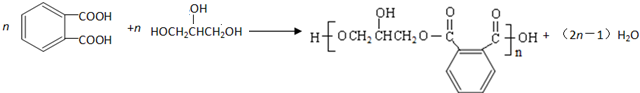
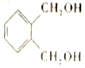 的符合下列条件的同分异构体有6 种(不考虑立体异构)
的符合下列条件的同分异构体有6 种(不考虑立体异构)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1=2c2 | B. | c1>c2 | C. | c1=c2 | D. | c1<c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com