
| A. | 氢 | B. | 碳 | C. | 氮 | D. | 硫 |
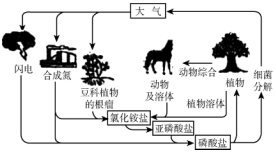
分析 氮循环是指自然界中氮单质和含氮化合物之间相互转换,大气中氮气和氧气放电生成NO,一氧化氮也会为二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,硝酸生成铵盐,工业合成氨和硝酸生成铵盐,豆科植物根瘤菌吸收空气中的氮气,得到铵盐、亚硝酸盐磷酸盐等.
解答 解:图中大气中氮气和氧气放电生成NO,一氧化氮也会为二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,硝酸生成铵盐,工业合成氨和硝酸生成铵盐,豆科植物根瘤菌吸收空气中的氮气,得到铵盐、亚硝酸盐磷酸盐等,动物体内的一部分蛋白质在分解中产生的尿素等含氮物质,以及动植物遗体中的含氮物质.它们被土壤中微生物分解后形成物质--氨,氨经过土壤中硝化细菌的作用,最终转化成硝酸盐.在氧气不足的情况下,土壤中的另一些细菌(反硝化细菌)可以将硝酸盐转化成亚硝酸盐并最终转化成氮气,氮气则返回大气中.氮循环属于自然界的物质循环.氮循环是指自然界中氮单质和含氮化合物之间相互转换,故选C.
点评 本题考查了氮的循环过程分析判断,图中转化关系的理解应用是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有氢离子 | B. | c(H+)=1.0×107mol/L | ||
| C. | c(H+)>c(OH-) | D. | c(H+)越大,酸性越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中的SO42-,加入HCl酸化的Ba(NO3)2溶液,观察有无白色沉淀生成 | |
| B. | 除去NO中混有的少量NO2,将混合气体通入水中,再用排空气法收集NO | |
| C. | 用NaNO3固体与浓硫酸微热制HNO3 | |
| D. | 通入CO2以除去Na2CO3溶液中混有的NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
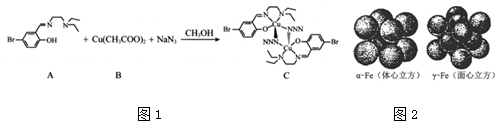
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
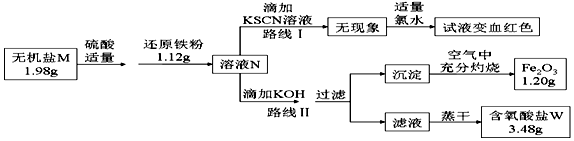
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2 | B. | NH3 | C. | NO2 | D. | HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com