
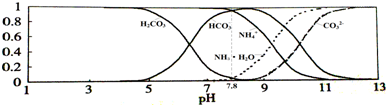
| A、NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3?H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 |
| C、通过分析可知常温下Kb(NH3?H2O)>Ka1(H2CO3) |
| D、当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3?H2O)>c(CO32-) |


科目:高中化学 来源: 题型:
| A、溴水中有下列平衡:Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
| B、对2HI(g)?H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
| C、反应CO+NO2?CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
| D、合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2(g)+3H2(g)?2NH3(g);△H<0) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用蒸发的方法除去食盐水中的泥沙 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、分液漏斗下层的液体从下面放出,上层的液体应换一个烧杯接收 |
| D、将22.4L氯化氢溶于水中,配成1L的溶液,即得1mol/L的盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性 | B、碱性 |
| C、氧化性 | D、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下Na2CO3产生的CO2体积大 |
| B、将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生沉淀 |
| C、向Na2CO3饱和溶液中通入足量的CO2会有NaHCO3晶体析出 |
| D、Na2CO3中含少量NaHCO3,可用加热法除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、③④ | C、②⑤ | D、①⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com