
无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
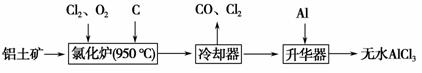
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为_____________________ _________________________________________________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为_______________________________________________________________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是___________ _____________________________________________________________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
①写出上述除杂过程中涉及的离子方程式:__________________________、__________________________。
②AlCl3产品的纯度为__________。
(5)工业上另一种以铝灰为原料制备无水AlCl3的工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是__________________ ______________________________________________________。
解析 (1)由经冷却器出来的气体有CO和Cl2可知,CO是氯化炉中的生成物,且Cl2是过量的,故氯化炉中发生反应的化学方程式为Al2O3+3Cl2+3C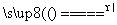 2AlCl3+3CO。(2)亚硫酸钠是还原剂,氯气是氧化剂,则离子方程式为SO
2AlCl3+3CO。(2)亚硫酸钠是还原剂,氯气是氧化剂,则离子方程式为SO +Cl2+H2O===SO
+Cl2+H2O===SO +2Cl-+2H+。(4)①除杂过程中涉及的离子方程式为Fe3++3OH-===Fe(OH)3↓,Al3++4OH-===AlO
+2Cl-+2H+。(4)①除杂过程中涉及的离子方程式为Fe3++3OH-===Fe(OH)3↓,Al3++4OH-===AlO +2H2O。②沉淀物经洗涤、灼烧、冷却、称重,得到的0.32 g固体物质是氧化铁,即其物质的量为0.002 mol,则氯化铁的物质的量为0.004 mol,即其质量为0.65 g,得出AlCl3的质量为16.25 g-0.65 g=15.6 g,AlCl3的纯度为
+2H2O。②沉淀物经洗涤、灼烧、冷却、称重,得到的0.32 g固体物质是氧化铁,即其物质的量为0.002 mol,则氯化铁的物质的量为0.004 mol,即其质量为0.65 g,得出AlCl3的质量为16.25 g-0.65 g=15.6 g,AlCl3的纯度为 ×100%=96%。(5)由于氯化铝易水解,水解后生成的氯化氢气体挥发后,使水解平衡正向移动,生成大量的氢氧化铝,故为了抑制其水解,必须在氯化氢的气流中加热脱去结晶水。
×100%=96%。(5)由于氯化铝易水解,水解后生成的氯化氢气体挥发后,使水解平衡正向移动,生成大量的氢氧化铝,故为了抑制其水解,必须在氯化氢的气流中加热脱去结晶水。
答案 (1)Al2O3+3Cl2+3C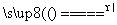 2AlCl3+3CO
2AlCl3+3CO
(2)SO +Cl2+H2O===SO
+Cl2+H2O===SO +2Cl-+2H+
+2Cl-+2H+
(3)除去FeCl3
(4)①Fe3++3OH-===Fe(OH)3↓ Al3++4OH-===AlO +2H2O ②96%
+2H2O ②96%
(5)在HCl气流中加热脱去结晶水


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )。
①氯气的性质活泼,它与氢气混合后立即发生爆炸 ②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收 ③新制氯水的氧化性强于久置氯水的氧化性 ④检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水中
A.①②③ B.②③④
C.③ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可生成CuH。下列叙述中错误的是 ( )。
A.“某物质”具有还原性
B.CuH与盐酸反应可能产生H2
C.CuH与足量稀硝酸反应:CuH+3H++NO ===Cu2++NO↑+2H2O
===Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2===CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe3O4是重要的化学试剂,铁粉在氧气中燃烧是制取它最为常见和快捷的方法。图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
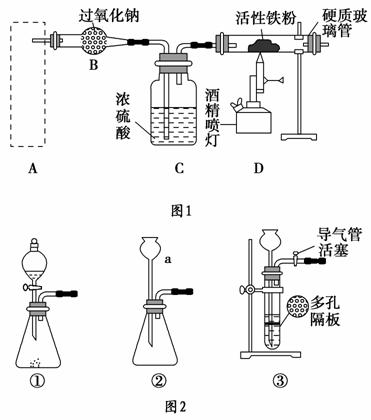
请回答下列问题:
(1)图2中仪器a的名称是________。
(2)根据题目要求,在图2中最好选择________(填序号)作为A装置。
(3)对图2中装置①进行气密性检查的方法是________,向分液漏斗中加足量水,过一会,水不再下滴,说明装置①的气密性良好。
(4)在B装置中发生的主要反应的化学方程式是_________________________ _______________________________________________________________________________________________________________________。
(5)当产生的气体与事先预热的铁粉接触时,在硬质玻璃管中将观察到的明显现象是________________________________________________________。
(6)反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有_______________________________________________________。
(7)若铁粉被完全消耗,某同学为确定生成物中有+2价铁,取少量生成物于试管中,加入适量的稀硫酸溶解。
①写出溶解过程发生反应的离子方程式______________________ ________________________________________________________。
②写出确定+2价铁所用试剂名称、操作步骤、实验现象和结论_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是 ( )。
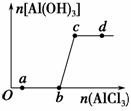
A.a点对应的溶液中:Na+、Fe3+、SO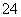 、HCO
、HCO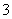
B.b点对应的溶液中:Na+、S2-、SO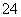 、Cl-
、Cl-
C.c点对应的溶液中:Ag+、Ca2+、NO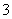 、F-
、F-
D.d点对应的溶液中:K+、NH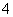 、I-、CO
、I-、CO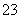
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )。
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
③钠在常温下不容易被氧化
④Na2O2可作供氧剂,而Na2O不行
⑤向石蕊试液中加入Na2O2粉末,溶液先变蓝后褪色,并有气泡生成
⑥钠与浓NH4Cl溶液反应,放出的气体中含H2和NH3
A.都正确 B.②③④⑤
C.②⑤⑥ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
一化学研究性学习小组对某Na2CO3和NaHCO3混合溶液的组成进行探究。取20.0 mL该混合溶液不断加入1.00 mol·L-1的稀盐酸,加入盐酸的体积和产生的现象见下表。
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现象 | 无气体 | 产生气体 | 无气体 |
则混合溶液中c(HCO )为 ( )。
)为 ( )。
A.1.00 mol·L-1 B.0.50 mol·L-1
C.1.50 mol·L-1 D.2.00 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机化学发展史的说法错误的是( )
A.中国科学家成功合成了结晶牛胰岛素,标志着人类合成蛋白质时代的开始
B.德国化学家李比希提出运用同位素示踪法研究化学反应历程
C.瑞典化学家贝采利乌斯提出有机化学的概念,使之成为化学的一个重要分支
D.德国化学家维勒用氰酸铵合成尿素,从而打破了无机物和有机物的界限
查看答案和解析>>
科目:高中化学 来源: 题型:
人们对未发现的第114号元素很感兴趣,预测它有良好的力学.光学.电学性质,它被命名为“类铅”。以下对“类铅”的叙述正确的是
A.最外层有6个电子
B.位于元素周期表的第七周期
C.主要化合价为-4价.+4价
D.电解硝酸铜与硝酸“类铅”的混合溶液时首先会析出“类铅”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com